
服務生醫產業超過25年,經歷研發/產品管理/事業開發/銷售業務/品保法規等工作,工作橫跨美國,台灣,產品經歷家用醫材/專業醫材/實驗室設備等,在這個園地貢獻自己一點經驗及想法。
醫材網路安全(Cybersecurity)實務討論-(1)概念
本人第一篇採用註冊 ISCN的文章。
開始
本文的主軸在於
(1)善用對設計管制 Design Control的熟悉,快速了解醫材網路安全(Cybersecurity)實務差異處
(2)台灣同業利用TFDA發佈的指引,快速了解醫材網路安全(Cybersecurity)實務要求,如測試手法,產出文件。
如果熟悉醫療器材設計的核心觀念,設計管制 Design Control。 那麼以此基礎來解構醫材網路安全(Cybersecurity)實務運作會事半功倍。
醫療器材設計方法論(5)-核心觀念 設計管制 Design Control
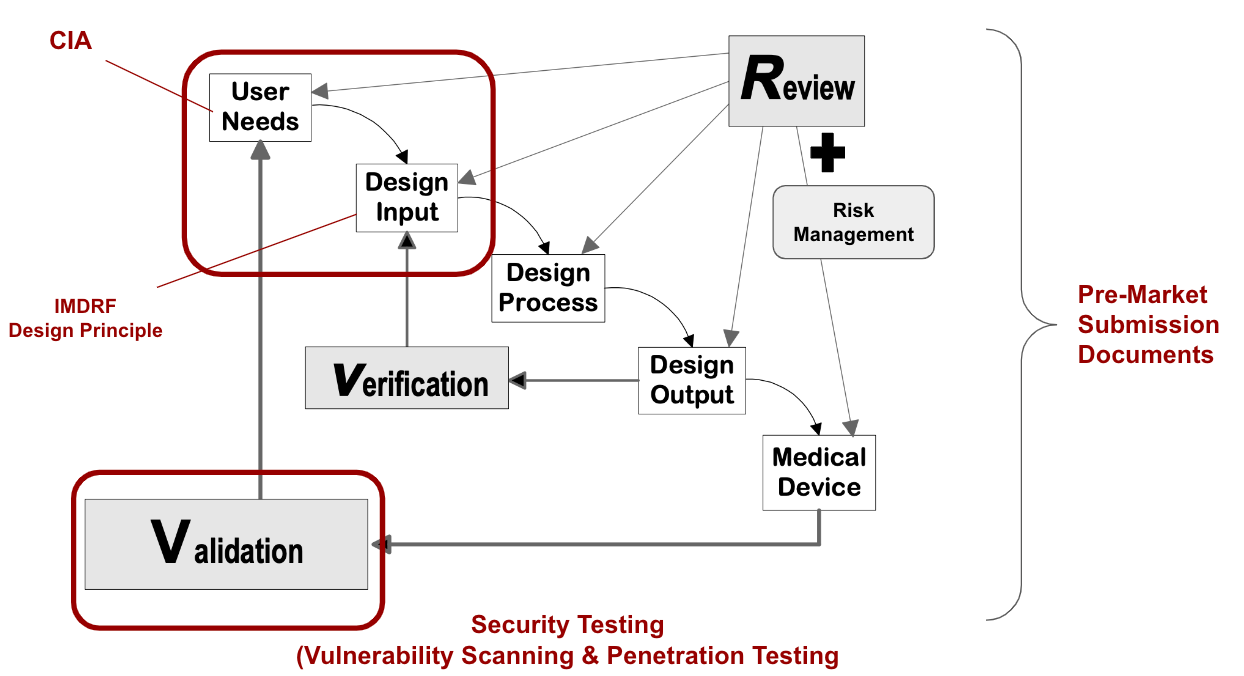
從FDA的設計管制 Design Control觀之,紅框的部分為醫材網路安全(Cybersecurity)實務差異的地方,但其他執行的觀念與其他醫材的設計,或是軟體開發作業相同。
簡述
醫材網路安全的目的就是就是把網路安全的要件導入設計,以符合維持醫材功效性,安全性的原則,而網路安全的要件就是CIA(Confidentiality, Integrity and Availability)。
因為醫療器材應維護其機密性 (Confidentiality)和完整性(Integrity);同時醫療器材亦應具備可取得性 (Availability)。
其可視為外來需求如同User need.
而要把CIA的規格具體化成設計輸入,這裡·建議採用的手法是IMDRF/CYBER WG/N60之5.1節的設計原則。
而後中間進行類似軟體開發的流程,也建立追蹤矩陣(Tracebility Matrix)確認設計輸入與設計輸出,以及設計驗證(Verification)的連結關係。
此外,風險管理的作業也在各個流程執行。
如同醫材的臨床確效(Validation),網路安全是經過Security Testing來確效醫材網路安全的設計是有效的。
最後,根據把這些過程如同設計輸出入,風險管理,驗證,確效等紀錄下來,就是提交認證機關的文件。
以TFDA指引架構來導讀
這裡藉由TFDA 網路安全指引架構對醫療器材的網路安全的實務運作有個全面的了解。
就台灣的同業而言,要了解醫材網路安全(Cybersecurity),最好的人門參考資料為以下TFDA發佈的衛福部公告「適用於製造業者之醫療器材網路安全指引」 【發布日期:2021–05–04】
衛福部公告「適用於製造業者之醫療器材網路安全指引」 【發布日期:2021–05–04】 發布單位:醫療器材及化粧品組-台南市進出口商業同業公會
英文版可參考這裡
採取TFDA的指引主要有幾個原因
(a)中文方便台灣同業閱讀
(b)TFDA綜合全世界的相關法規,做了非常精要的整合,整個指引有17頁(但實際內容為15頁),這對掌握相關醫療器材的網路安全的規範可以有個很快速的了解
導讀如下
從熟悉醫材開發流程的角度來看TFDA的指引
(1)基本觀念,就是把網路安全的要件導入設計,以符合維持醫材功效性,安全性的原則
(2)這些要件要達到的目的就是CIA,醫療器材應維護其機密性 (Confidentiality)和完整性(Integrity);同時醫療器材亦應具備可取得性 (Availability)
(3)網路安全納入設計輸入,並建立網路安全管理方法與措施,作為軟體確效及風險分析的一部分
(4)設計原則參考IMDRF/CYBER WG/N60之5.1的設計原則
(5)將網路安全風險(Cybersecurity Risk)納入在安全風險(Safety Risk)分析
(6)與軟體開發流程同,網路安全設計與風險管理(Risk Management)結合,佐以追蹤矩陣(Traceability Matrix)連結
(7)網路安全的功效需要被確效,如同醫材的功效由臨床驗證確效,最後用Securuty tesing的手法來確效
(8)以上為上市前的步驟,所以就以上流程產生對應的文件供監管機關審核。
(9)上市後監管除了採用以前的上市後監督PMS觀念外,網路安全是要關係者(stakeholder)一起維護,而共通性的網路安全危害訊息揭露政策與規範為整個關係者的重要措施 。(註1)
(10) 遇到危害,以及相關的處置
後記
TFDA的指引綜合全世界的相關法規,做了非常精要的整合,所以與其他國家/區域如FDA,CE MDR的要求,會有局部的差異,如對關係者(Stakeholder)的工作描述,TFDA採用制定政策來說明,而FDA,MDCG,IMDRF採用比較具體的說明。
此外,IMDRF強調TPLC(Total Product Life Cycle)的流程,TFDA的內容也有提到類似觀念,只是沒有IMDRF開宗明義地強調。
但對整個醫材網路安全(Cybersecurity)實務運作的概念是一致的。
下一章,將對差異做個比較。
註1: TFDA看來好像提到政策為主,但其他如FDA,MDCG,IMDRF等都有闡明關係者(Stakeholder)工作內容。
喜欢我的文章吗?
别忘了给点支持与赞赏,让我知道创作的路上有你陪伴。
发布评论…