
阅读·实修·转化
626 笑松:流感大爆发的百年回顾
野兽按:前天看到中国数字时代的这篇:【CDT敏感词周报】石家庄疫情、国会冲突、香港抓捕、朱令
01/08/2021
测试时间:2021年1月1日——1月7日
测试平台:新浪微博、微信、知乎、抖音、快手、B站
石家庄疫情
新闻背景:河北省会石家庄在1月7日晚宣布"封城"。河北省石家庄市副市长孟祥红在当晚举行的新闻发布会上表示,由于正在进行全市范围内的核酸检测,所有车辆及人员均不得出市,该城市高风险地区藁城区的居民也不得前往其他地区。
敏感词:“石家庄+封城”,“石家庄+不得离市”,“石家庄+爆发”,“河北+爆发”,“疫情+发布会”,“河北+战时状态”等多种组合。
敏感度:有大规模人工审查痕迹。
新浪微博除了可以搜到少数记录封城造成生活不便的内容,甚至有少量对政府发布会,以及仓促封城不满的内容。但在主要关键词“石家庄封城”下优先展示了大量官方宣传内容,同时对评论进行了人工单审,或关闭转发带评论,对转发自动止。转发带评论大量被删后出现了“由于部分用户进行定向转发,无法查看剩余转发内容”的文案。而央视新闻的一条贴文下,由于单审尺度严厉,大部分评论遭过滤后,出现了转发/评论数量比例极不协调的现象。
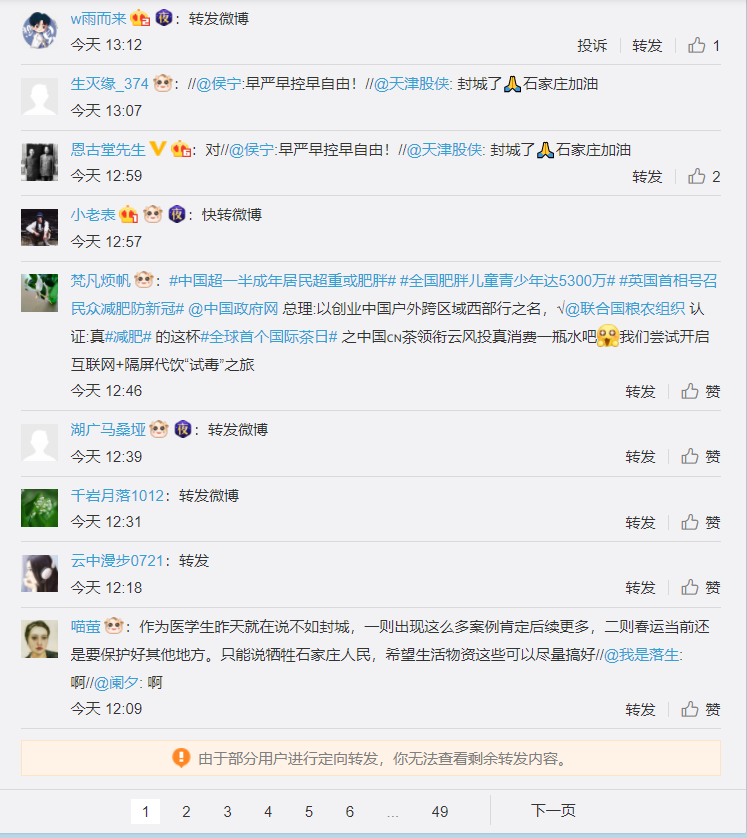
知乎搜索相关话题时,优先展示了“热点”内容进行引导。
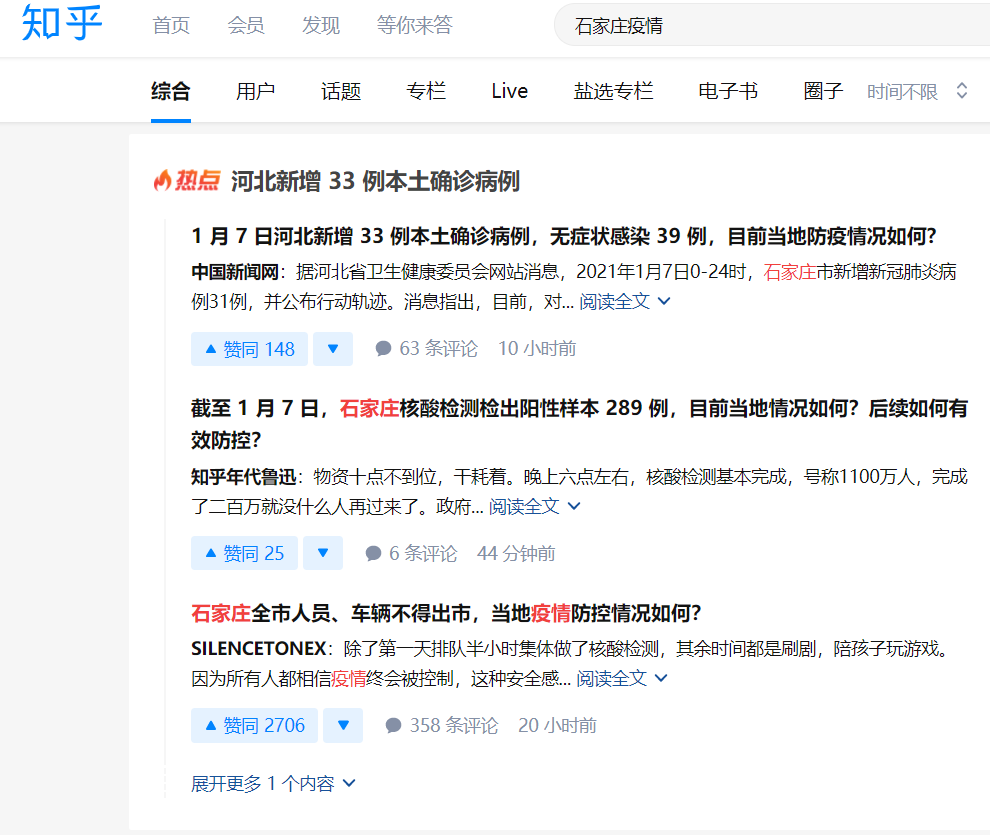
B站则保留了少量生活记录和官方媒体报道,结果偏少。
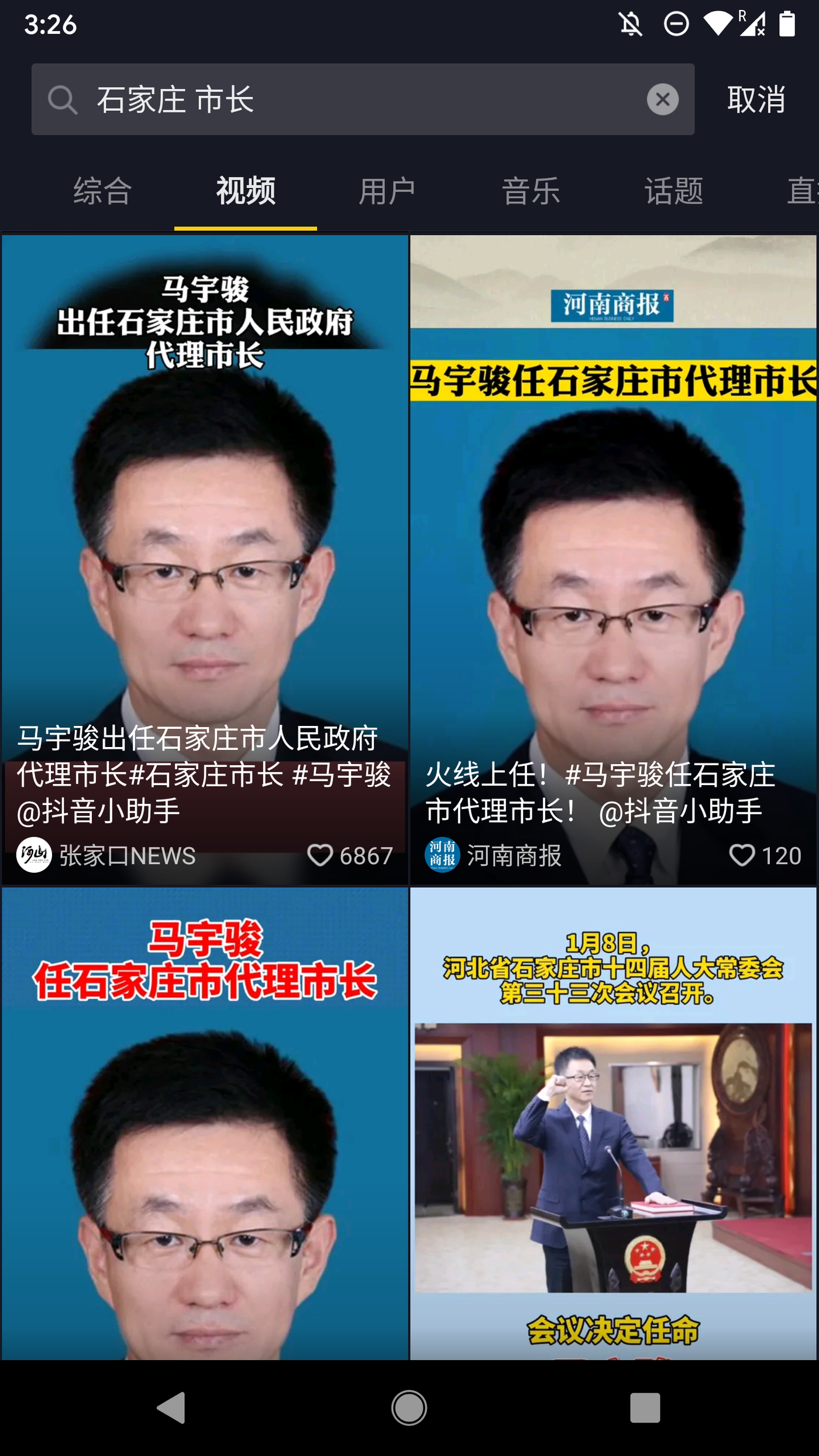
扩展搜索:“石家庄市长”,“邓沛然”,“河北+护城河”
背景:2021年1月8日,马宇骏被任命为石家庄市代理市长,此前的2020年12月21日,河北省纪委监委官网消息,时任石家庄市委副书记、市长邓沛然涉嫌严重违纪违法,目前正接受省纪委监委纪律审查和监察调查。
除微博可以通过“邓沛然”检索到少量内容,其他平台均为极高敏感度。而在抖音,无论搜索“石家庄市长”或“邓沛然”,都只能得到代市长马宇骏上任的大量同质化内容。
国会冲突
新闻背景:1月6日,美国总统特朗普的支持者在国会大厦前与警察发生冲突,部分示威者闯入了国会大厦,数小时后警方宣布平息了这场骚乱,但迄今为止已造成5人死亡。中国官方立即围绕此事展开了舆论攻势。
【网络民议】美国国会冲突事件成“世界名画” 中方或成最大赢家
非敏感关键词:“国会暴乱”,“国会骚乱”,“国会抗议”,“香港+暴徒”
敏感词:“稍有常识+美国国会”,“螳臂当车+国会”,“坦克+美国国会”,“华盛顿+卫戍部队”,“国会+清场”,“国会+屠杀”。
敏感度:多重标准。
此次美国国会骚乱在中国社交媒体引发热议,但因中国官方对美国大选“不得擅自报道”的指令,大部分报道和讨论的消息来源都来自将之与香港抗议对比的官方通稿,以至于搜索香港抗议活动相关的部分关键词,结果都会导向美国国会骚乱。
而如果以六四事件进行联想,将美国国会比作人民大会堂的关键词,例如“国会+清场”,“国会+屠杀”等,都会遭到禁止。
香港抓捕
新闻背景:香港警方1月6日出动千名警员,对去年参加立法会选举民主派初选的53名人士进行了拘捕,指他们涉嫌“颠覆国家政权”。欧盟委员会通过发言人斯塔诺(Peter Stano)与美国候任国务卿布林肯(Anthony Blinken),均表示谴责,并呼吁中国当局释放被捕人士。
敏感词:“香港+抓捕”,“关尚义”,“香港+美国公民”等。
敏感度:一般。
涉香港话题讨论较少,结果以官方宣传为主,且大多导向美国国会冲突事件的宣传内容。
对首位美国公民关尚义因港版国安法被拘捕的敏感议题,仅微博存在少量内容。
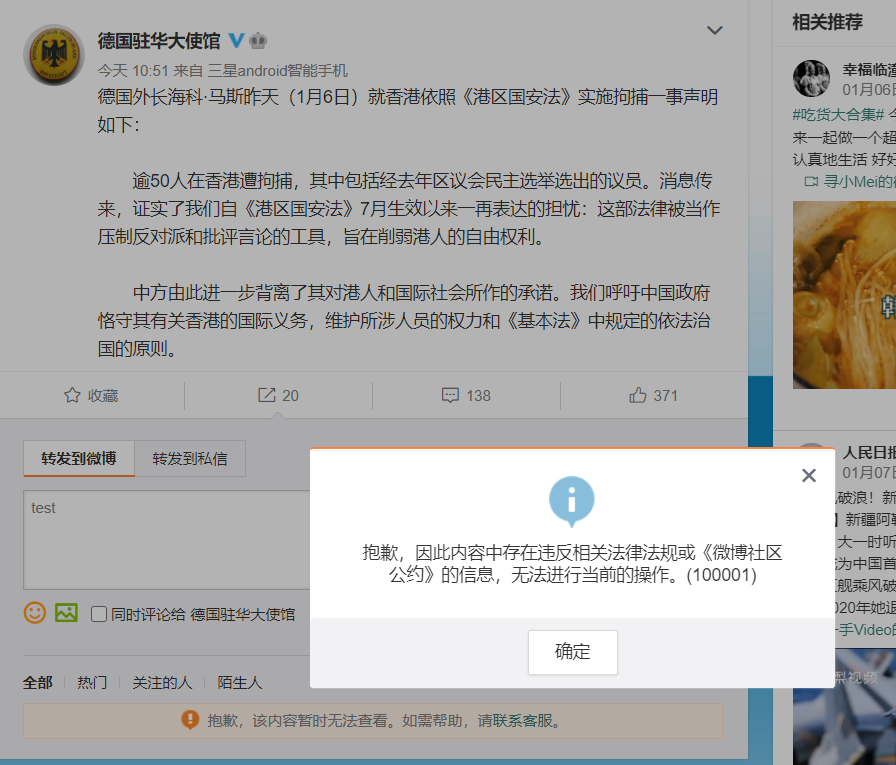
外国驻华使馆对此事件的声明微博遭到高强度审查和干扰,德国驻华大使馆的一条微博被同时设置了禁止转发,评论先审后发,评论单审,并配合网评员进行了舆论引导。
朱令
新闻背景:朱令铊中毒事件是指清华大学1992级化学系女生朱令在1994年11月底出现铊中毒症状,最后得助于互联网才得到确诊和救治的事件。1995年5月北京警方对此立案调查,1998年8月无果结案,至今真凶仍未归案,此事件在中文网络至今仍被广泛关注和讨论,而孙维(孙释颜)是该案唯一的犯罪嫌疑人。据网友1月1日分享,知乎已将朱令相关话题下线。
敏感词:“朱令”,“孙维”,“孙释颜”
敏感度:一般。
仅知乎禁搜了“朱令”一词,通过“孙维”,“孙释颜”仍然能够搜索到朱令案相关讨论,但此前涉及对孙释颜(原名孙维)的人肉搜索和高赞讨论无法被检索到。
其他平台也一定程度上清理了孙维相关内容,但处理较生硬和被动。抖音甚至没有将搜索的自动补全清理,但相关内容无法被找到。
笑松:流感大爆发的百年回顾
“历史告诉我们,世人从未以史为鉴。”
—— 黑格尔
1918人间惨剧——西班牙大流感
1918年3月初,一个普通的早晨。
美国堪萨斯州的莱利堡军营里,一名新兵在早饭前走进军营医院求医。军医一检查,发热,咽痛,头痛 ——嗨,伤风感冒,头疼脑热的小毛病,没事!
这位军医万万想不到,他见证了正式纪录在案的人类历史上一场空前的瘟疫——西班牙大流感——最早的病例之一。
一分钟后,来了第二个病人。接着是第三个, 第四个…… 到中午,病号的数目已经过百,一周后达到了五百。那个春天,莱利堡军营里一共有48人死于流感,全都是青春年华的小伙子。
当时正值第一次世界大战,美国作为交战国之一,正在全国各地征召大批兵员,集中训练后输往欧洲战场。流感爆发之初,美国政府卫生部门并未给予足够重视,采取必要的防控措施。早期的病例往往被误诊,或者被当作一般的季节性流感,从而延误了控制疫情的最佳时机。到了3月中旬,流感病例开始在纽约的皇后区出现,接着就被运兵船带到欧洲,随之再像野火一样蔓延全球,连远在太平洋中的小岛和北极圈里的村镇都不能幸免。
1918年春季爆发的第一波流感,虽然传染能力强,患者的病情却相对温和,死亡率也不算特别高。可是短短几个月后,却发生了一个更加致命的剧变。到了8、9月份,第一波流感的高峰已经消退,在法、美等国却相继出现一大批更加凶险的病例。此后的六个月里,流感病死率大幅上升。学界一般认为,这是由一株变异的流感病毒造成的。
第一波流感病毒被美军带到欧洲前线后,在战壕和碉堡里拥挤污秽的环境中迅速扩散。流感病毒属于RNA病毒,而RNA病毒的复制精确度不如DNA病毒,所以出现复制错误,造成基因突变的频率特别高。因此流感病毒在大量繁殖的过程中会出现许多随机突变,形成毒性强弱不一的病毒变种。毒性减弱的突变病毒感染的士兵病情轻微,被留在前线坚持战斗,这就限制了这样的“良性”病毒变种扩散的机会。而毒性增强的突变病毒所感染的士兵病情危重,这样的重病号往往与重伤员混杂在一起,优先撤回后方医院救治,烈性突变病毒也因此被带到更大的范围,包括传回美国,感染更多的军人和平民,造成第二波流感大爆发。西班牙流感造成的死亡大部分发生于这一波疫情。
1918年的美国联邦政府开足马力,为大战全力以赴,对于抗疫则没有任何统一部署。时任总统威尔逊不论在公开或私下场合,都没有留下关于抗疫的言论记录。负责管理公共卫生事务的卫生总监布卢,在流感疫情初起时无所事事,没有釆取任何应对措施。直到9月中旬,流感病例已经在美国东部、中西部、南部成百上千地出现时,布卢还宣称“这是流感,不过就是流感”,“对流感实施严格的隔离,显然没有必要"!
与此同时,大规模的征兵和集训仍在继续。伊利诺伊州一处名为格兰特堡的军营内,有4万名新兵。9月21日,军营里出现了第一批流感病例。一周之内,病号数目就超过了4千人,并且以每天一千的速度增加。尽管如此,还是有三千多名士兵奉命登上一列火车,转移到乔治亚州去。车厢内拥挤不堪,空气污浊。到达目的地后,三分之二的士兵因流感被送入医院,最终死亡的人数超过10%。
10月4日开始,格兰特堡每天的死亡人数超过了一百。10月8日,军营指挥官哈格登上校又一次听取了最新的死亡人数报告后,命令身边所有的下属离开。
一声枪响,曾历经战火洗礼的上校结束了自己的生命。
1918年秋季,为了增援欧战前线,数以十万计的美军通过海运被紧急送往欧洲。从纽约起程的运兵船上,每个船舱中塞进多达400名士兵。近乎密闭的船舱犹如流感病毒的培养箱,横渡大西洋的航程成了名符其实的死亡之旅。死者的尸体被成批地葬入大海。幸存者登陆后将流感又带到前线,使更多的军人遭到感染。
军营外的美国城乡,同样处处笼罩着流感死神的阴影。有工人在上班途中突然发病,倒毙于路旁。有家人早晨将孩子送进学校,晚上等回来的是校长的一纸通知,孩子已被流感夺去生命。还有四个妇人夜间一起玩牌,到天明已有三人死于流感。高峰期间,美国有些城市每周死亡的人数高达一万。许多城镇棺材脱销,掘墓人难寻,流感患者的死尸无法及时单独处理,只能草草集体掩埋。全美三分之一的医生被征召入伍,更令本已捉襟见肘的医疗系统不堪重负,只能让医学院的高年级生一律停课,分派到医护岗位上顶班。流感强烈地冲击着社会生活的方方面面。
西班牙流感的大爆发与大战环境密切相关,而大战的进程本身也受到流感影响。流感使交战双方军队大批减员,战斗力锐减。倒在欧洲战场上的美军士兵有一半是死于流感,而非敌方火力。在后方,流感对社会经济和政府财政造成的负担越来越重,厌战情绪日益高涨,这些都成为促成停战的重要因素。同盟国一方的德、奥等国首先派出使者认输求和,交战双方在1918年11月11日正式签署了停战协议。
大战结束了,流感却并未就此终止。从前线复员返乡的大批军人继续把流感带到四面八方。有些城市为庆祝停战,不顾禁忌举行了大规模的集会游行,结果乐极生悲,促成流感在当地的大爆发。
第二波流感的高峰到1919年初逐渐减退。到了春季,又出现第三波疫情,不过这一波的患者病情和死亡率不如前一波严重。有学者认为它可能是由新产生的一个“良性”变异病毒引起的。此时大战已经结束,和平环境下,烈性病毒感染的重症病人通常被收入医院或被困在家中,与外界接触有限,随着病人的痊愈或死亡,这些病毒的扩散就自然终止了。而被“良性”突变病毒感染的病人症状轻微,病人还有可能外出活动,促进了这些病毒的扩散。到了夏天,第三波的高峰过后,疫情逐渐消退,直到1920年,西班牙流感爆发的两年之后,才完全消失。
行文至此,读者可能会问,这场瘟疫的起源似乎与西班牙无关,怎么会被称为西班牙流感呢?这要归咎于大战期间的新闻管制。为了避免透露国情,影响士气,各交战国的媒体都对本国的流感疫情讳莫如深,而作为中立国的西班牙媒体对此并无禁忌。据分析,西班牙的流感其实是从作为交战国之一的邻国法国传入的。在本国出现流感疫情,连国王和一些政府高官也被感染后,西班牙媒体立即大肆加以报道,以致造成这场流感起源于西班牙的印象,西班牙大流感因此得名。
据估计,历时两年的西班牙流感大爆发造成全球范围内五千万至一亿人死亡,死亡人数约占当时世界总人口的5%,远远超过了历时四年的第一次世界大战期间各国死于战火的军民总数。以美国为例,67万5千人死于西班牙流感,这个数字十倍于战死沙场的美军人数。西班牙大流感因此成为人类历史上最为悲惨的一次瘟疫。
一场流感,两次大战
1919年初,各战胜国代表齐聚法国,举行巴黎和会,商讨战后事宜。主导会议进程的,是协约国一方号称“四巨头”的美、英、法、意四国的代表,其中最关键的人物,是美国总统威尔逊和法国总理克莱门索。克莱门索执意严惩法国的宿敌、战败国一方的德国,提出了要求德国割地赔款的严苛条件。威尔逊从建立持久和平的战后秩序出发,主张对德国宽容处置,实现“没有胜利者的和平”。二人进行了针锋相对的艰苦谈判,但无法达成协议。
谈判僵持不前时,威尔逊一度表示宁可谈判破裂也绝不放弃原则,并且下令准备离法返美。就在这个关键时刻,威尔逊染上了流感,高烧摄氏40度,一连几天卧床不起。等到他终于能够起身,重返谈判桌时,总统的随从发现他神情恍惚,反应迟缓,完全变了个人。最令人吃惊的是,威尔逊竟然稀里糊涂地放弃了自己原先坚持的立场,全盘接受了克莱门索的要求。
西班牙大流感期间以及之后,都有医生观察到流感不仅影响呼吸器官,在一部分病人身上还累及大脑,造成各种神经及精神症状。有史学家坚信,威尔逊就是这样一个流感幸存者。
1919年6月28日, 凡尔赛和约正式缔结。德国承担挑起战祸的全部责任,除了付出巨额赔款,还放弃了战前领土的10%和所有的海外殖民地。资源丰富的萨尔地区脱离德国管辖,其煤矿交由法国开采,作为赔偿的一部分。战后的德国不得拥有空军,陆军和海军的规模也受到严格限制。德国接受了凡尔塞和约的条款之后,连威尔逊本人也对他的下属表示:“如果我是德国人,我大概真不该在那上面签字。”
凡尔赛和约使德国的国民经济和民族自尊心遭到重创。战后的德国,百业萧条,物价飞涨,民不聊生,怨声载道,极端民族主义、复仇心理和排外情绪抬头,致使纳粹法西斯趁机崛起。到了1935年,羽翼渐丰的希特勒终于悍然撕毁凡尔赛和约,一步步地将人类拖进更为惨烈的另一场世界大战。
如果威尔逊在巴黎没有罹患流感,或者在他病倒之前就终止谈判返回美国,巴黎和会乃至战后历史的进程会是如何?谁也不知道。历史的词汇里没有 “如果”。历史只记录发生了什么。1919年春天在巴黎和会上发生的一切,使人不得不相信,威尔逊的这场流感,为20年后的第二次世界大战埋下了祸根。如果说一只蝴蝶在南美洲亚马逊热带雨林中扇动几下翅膀,尚且可以在两周后引起美国德克萨斯州的一场龙卷风,一个举足轻重的大国领袖在关键时刻的一场重病,影响历史进程也就不足为奇了。人类史上仅有的两次世界大战,竟然与同一个小小的病毒都有关系,令人怎能不唏嘘!
抗疫双城记
西班牙流感席卷美国时,在既无有效药物又无预防疫苗的情况下,各自为政的地方政府各自为战,分别采取了不同的公共卫生应对措施。这些做法对于当地的发病率和死亡率的影响究竟如何,众说不一。直到本世纪初,美国和荷兰的两组流行病学家和统计学家从历史文献中发掘数据,还原了当年美国十几个城市的疫情发展过程,进行细致的统计分析研究,得到的结果分别被写成论文,于2007年在同一期《美国科学院院报》发表,成为制定新发传染病大爆发的公共卫生应对策略的重要借鉴 [1,2] 。
研究人员发现,在死亡人数最多的1918年秋冬两季,这些城市的疫情发展曲线图可大致分为两类模式。第一类的特征是发病及死亡人数急剧增加,几周之内就达到高峰,随即开始下降,逐渐消失。第二类的特征是新发病例数缓慢增加,达到一定高度(大约相当于第一类的一半左右)时开始下降,但是几周之后再次增加,达到第二个峰值,然后再次下降,逐渐消失。换句话说,第一种模式是在短期内出现一个很高的发病率峰值,第二种模式是在较长的期间出现两个较低的发病率峰值。比较两种模式下的累计死亡率,第二种模式比第一种模式约低10% 到30%。
第一种模式以美国东海岸的费城为代表。1918年9月17日,该市出现第一个流感死亡病例。为了防止疫情蔓延,市政府于次日散发了两万份传单,号召市民不随地吐痰,咳嗽、喷嚏时掩盖口鼻,除此之外没有采取其它措施。几天之后,为了鼓舞市民踊跃认购战争债券,积极为大战努力贡献,还组织了一次有20万人参加的大游行。此后 ,费城的流感病例急剧增加,直到10月3日,也就是第一个死亡病例出现后的第16天,市政府才决定关闭学校、教堂、剧院以及其它公共场所,禁止集会,但为时已晚。游行过后仅仅一周 ,发病人数就增加到4万5千多人;六周以后,全市死亡人数达到1万2千,成为全美流感死亡最惨重的城市之一。
与费城形成对照的是美国南方的圣路易斯市。紧接着费城之后不久,10月5日圣路易斯也出现第一个流感病例。两天之后的10月7日,市政府就迅速关闭了大多数公共场所,将所有的病患隔离在家。及时采取的行动取得了效果,管控期间圣路易斯按人口平均的流感死亡率只及费城的八分之一。早期防疫的显著成效令市政府当局志得意满 ,疫情缓和后,就放松了管控。不料疫情就此反弹,很快又出现第二波发病及死亡高峰,致使早期管控取得的成绩大打折扣。到12月底,圣路易斯按人口平均的累计流感死亡数上升到费城的一半。类似的疫情反弹也出现在其它一些实行了早期管控的城市。
当一种新发的呼吸道病原体出现于一个普遍缺乏免疫力的人群中时,如不采取任何干预措施,任凭疫情蔓延发展,那就只有在被感染恢复后获得免疫力的个体达到一定比例,实现了群体免疫之后,疫情才能终止。这也就是西班牙流感在爆发流行两年,造成全球几千万患者死亡以后,最终消失的原因。而如果对民众的行为进行积极干预,实行所谓的“社交疏离”,阻断呼吸道病原体从人到人的传播途径,就可以减缓疫情蔓延和死亡人数增加的速度。所采取的干预措施越全面彻底,效果越明显,但关键是这些防疫措施必须在疫情初发时尽早开始,而且维持足够长的时间。
1918年秋季,那些及时实行了社交疏离政策的美国城市都成功地降低了早期的发病率和死亡率,然而大多数城市在2至6周之后就放松了管控。此时由于人群中已经获得免疫力的人数远未达到群体免疫所需的比例,众多的个体仍然能被感染,在依然存在少量本地或者外来传染源的情况下,管控措施一旦放松,民众的高危行为一旦恢复,疫情必然反弹。
两组研究人员得出的结论是,对于未来新发病原体引起的传染病大爆发,唯有尽早采取各种措施阻断传染途径,减缓疫情发展速度,利用争取到的宝贵时间尽快开发有效的治疗药物和预防疫苗,才有可能减少死亡人数,以最小的生命代价终止疫情 [1,2]。
谁能想到,西班牙大流感爆发的百年之后,2020年新冠病毒横扫全球五大洲,在此起彼伏的一波波疫情中,我们仿佛看到一个又一个21世纪版本的"费城"和"圣路易斯"¬……
【华夏文摘】笑松:流感大爆发的百年回顾(二)
1918年的西班牙大流感发生在第一次世界大战期间,瘟疫加战争,其结果是人类史上一场空前的惨剧。〔详见:笑松:流感大爆发的百年回顾(一)〕造成这场瘟疫的元凶是什么?在它的流行期间以及前后的许多年,流感病毒的存在完全不为人所知。
发现病毒,疫苗诞生
早在西班牙大流感之前30年,德国著名的细菌学家菲佛(Richard Pfeiffer)从流感患者鼻腔中分离得到一种细菌,将它接种到一些实验动物身上能引起疾病。虽然患病动物的症状不像人类的流感,但菲佛相信这种细菌就是流感的病原体,并将它命名为“流感杆菌”。由于菲佛的崇高声望,他的这一结论被普遍接受,医学界干脆称之为“菲佛杆菌”。今天它的名称是“流感嗜血杆菌”,这种细菌可以存在于人体内但并不引起任何症状,而在人体遭病毒感染或其它原因致使免疫力下降时,就有可能引起儿童脑膜炎或其它疾病。
西班牙流感大爆发时,由于其病势凶险,不同于以往的流感,为了确定这究竟是什么疾病,研究人员在困难的条件下进行了一系列的研究。他们从一些病人身上除了分离得到菲佛杆菌,还得到其它细菌,包括肺炎双球菌,溶血性链球菌等等。这些细菌因此被认定为西班牙流感的病原体,其中一些还被大量培养出来,杀死之后制成疫苗给人群接种,希望以此控制流感疫情。我们今天知道,这些细菌有可能在流感患者体内造成继发性感染,引起细菌性肺炎。尽管肺炎是西班牙流感死亡患者中很大一部分人的直接死亡原因,这些细菌并不是流感的病原体。用它们制成的疫苗,充其量可以减少某些继发性细菌感染的机会,对于防止流感则毫无作用。
1918年,西班牙大流感波及美国爱荷华州时,这个畜牧业大州的养猪农户发现,在猪群中也出现一种传染病的爆发流行,病猪的症状和人流感类似,因此被命名为猪流感。11年后,猪流感在爱荷华再一次爆发。美国学者刘易斯(Paul Lewis)和肖普(Richard Shope)在病猪的肺部发现一种和菲佛杆菌十分相似的细菌,二人一度相信这就是造成猪流感的病因,并将它命名为“猪流感杆菌”。可是很快就发现一个问题:将分离纯化的细菌接种到健康猪体内,并不引起疾病 [3]。
20世纪初的医学界已经知道,能引起传染病的病原微生物除了细菌,还有一类“滤过性病毒”,体积比细菌小得多,可以从过滤细菌用的陶瓷过滤器通过,并因此得名。肖普于是用陶瓷过滤器过滤病猪的肺部抽提样品,然后以除去了细菌的滤液接种健康猪只,结果发现不含细菌的滤液能使猪患流感,但症状轻微;而如果用滤液加纯化的猪流感杆菌同时接种,诱发的疾病就特别严重。这一实验证明了猪流感的病因是病毒而不是细菌,细菌只是在病毒感染的基础上,使病症加重的帮凶 [4]。
猪流感病毒在1931年被发现以后,苏格兰有个病毒学家莱德劳 (Patrick Laidlaw)想用同样的方法来寻找人类流感的病原体,但一直没有找到一种合适的动物模型,因此未能成功。到了1933年2月,他手下的一名研究人员安德鲁斯(Christopher Andrewes)得了流感。这时莱德劳实验室里正好养了一批雪貂(又名白鼬),这是一种小型哺乳动物,莱德劳正在用它作为模型,研究感染狗、猫等动物的犬瘟热病毒及其疫苗。于是安德鲁斯的同事史密斯(Wilson Smith)收集了安德鲁斯的鼻咽部灌洗液,过滤后尝试接种到两只雪貂的鼻腔中。随即观察到,雪貂出现了类似人流感的症状!
就在史密斯摩拳擦掌,准备从那两只雪貂采集样品作进一步研究时,实验室雪貂群中爆发了一场犬瘟热,史密斯那两只宝贵的实验雪貂也被感染,实验功败垂成。所幸(或不幸?)几周之后,史密斯自己也得了流感。这一次轮到安德鲁斯收集史密斯的鼻咽部灌洗液,过滤后接种到健康雪貂的鼻腔使之发病,随后从患病雪貂中分离得到了流感病毒,按史密斯英文姓名的首字母将其命名为W. S. 病毒。史密斯、安德鲁斯和莱德劳在《柳叶刀》发表了这一结果,这就是第一次被发现的人类流感病毒 [5]。
此后莱德劳与肖普又分别发现,1918年西班牙流感幸存者的血液中,含有能识别猪流感病毒,保护猪只免遭感染的抗体。他们因此猜测,猪流感病毒或许是造成1918年西班牙大流感的人流感病毒的某种形式的后代 [6]。
1936年,澳洲病毒学家伯涅特(Macfarlane Burnet)发现流感病毒可在鸡胚(即孵化过程中的受精鸡蛋)中繁殖扩增。第二次世界大战期间的1944年,美国病毒学家弗兰西斯(Thomas Francis)将鸡胚中产生的流感病毒用甲醛杀死,第一次制成了流感疫苗。鉴于西班牙流感在第一次世界大战中给美国军民造成的惨重损失,流感疫苗迅速得到批准,于1945年首先供应军用,次年起也供应民用。流感疫苗从此成为预防流感的重要手段。直到今天,流感疫苗的病毒原料主要还是用鸡胚生产的。
每年秋冬季节,都是各种呼吸道传染病的高发期。感染呼吸道的病原微生物种类繁多,最常见的是鼻病毒、腺病毒、冠状病毒等普通感冒病毒。其中的四种冠状病毒,是能引起重症肺炎的2003年SARS-CoV冠状病毒和2019年SARS-CoV-2新型冠状病毒的远亲。除此之外,就是每年一度由流感病毒引起的疫情相对轻微的季节性流感,以及每隔若干年可能发生的全球性流感大爆发。1918年的西班牙大流感就是其中最严重的一次。
各种呼吸道病毒的感染仅靠症状往往不易区分,只有在病人的鼻咽部黏膜表面采集细胞样本,检测病毒核酸,才能确定病原体。以近年来流感疫情最严重的2017-2018 年流感季(在北半球为10月初到次年5月中)为例,全美国一共检测了120万份呼吸道感染病人的鼻咽细胞样本,其中大约五分之一确定为流感病毒感染。比例虽然不高,但在通常年份的各种呼吸道病原体中,危害最大的就是流感病毒。
流感病毒感染的对象不受年龄限制,不过感染后病情最严重的通常是老人和幼儿。全世界每年死于流感的人数在40万以上。在美国,直接与间接由流感病毒造成的死亡,包括流感病毒和继发性细菌感染引起的肺炎、以及病毒感染致使病人原有基础性疾病(如心血管病)恶化造成的死亡,平均每年约3万人,其中70-90%是65岁以上的老人。流感在美国通常年份的所有死亡原因中位列第七或第八,是传染病中的头号死因。根据中国学者的研究,2010 至2014年间,中国每年约有8万8千人死于流感病毒造成的呼吸系统疾病,不包括因流感病毒感染致使患者的其它疾病恶化造成的死亡 [7, 8]。
除了生命的损失,流感病毒造成的财产损失也不容忽视。美国每年用于流感及相关疾病的直接医疗费用约100亿美元,由于疾病和死亡而减少的收入约160亿美元,而由流感直接与间接造成的经济负担总额则高达900亿美元,大约相当于2019年美国GDP的0.4%。请注意, 美国GDP的年均增长率不过是2%左右。
由于流感病毒很容易发生突变,使先前通过感染或接种疫苗所获得的免疫力失去保护作用,世界卫生组织(WHO)每年根据全球各地采集的流感病毒样本,预测下一年流行的病毒株,以此作为疫苗的成分。尽管预测不可能总是准确无误,而且在预测准确的情况下,现有流感疫苗的保护效果也仅有40%-60%,远非完美,每年按时接种疫苗仍然是降低流感风险的安全有效方法。
1957亚洲流感——疫苗建功
西班牙大流感之后,年复一年,季节性的流感每年如期而至,疫情时轻时重;全球性的大爆发则没有再发生,一直到1957年。
从1940年代后期开始,有两家机构在世界范围内监控每年的流感疫情,一家是美国军方的沃尔特里德研究院(WRAIR),另一家是新成立的WHO。1957年4月7日,WRAIR负责流感研究项目的微生物学家希尔曼(Maurice Hilleman)正在办公室里阅读当天的《纽约时报》,看到一条新闻,在香港有成千上万的流感病人在医院排队等候就诊,全市已有10%的居民患病。希尔曼不由得惊呼:“我的天,这不就是流感大爆发吗?它来了!”可是无论WRAIR或者WHO,此前都没有注意到任何征兆 [9]。
希尔曼一刻不停地开始行动。他向美军驻日本的一家医疗实验室发去电报,要求他们调查香港的流感疫情。后者派出的一名军医随即找到了在美国军舰上服役的一名水兵,停靠香港时曾经登岸,接触过流感病人,随舰返回日本后就病倒了。军医让病号用盐水漱口,收集漱口水后送回美国。希尔曼于5月17日收到这份样品,立即开始夜以继日地工作。他将这个病人的漱口水接种到受精的鸡蛋中,果然培养出了流感病毒,用它检验了几百份采自美国军人及平民的血液样品,没有发现一份血样含有针对这种病毒的抗体,表明这几百人对这株病毒都没有抵抗力。五天之后的5月22日,希尔曼向媒体宣布,一场新的流感大爆发已经发生。
希尔曼将病毒同时分送到美国的其它几个研究机构以及WHO,作进一步的广泛检验。结果发现,在全世界范围内,只有美国及荷兰一些70岁以上的老人带有对这种病毒的抗体。那些老人经历过上个世纪1889 – 1890年的一次流感大爆发,那次爆发所流行的病毒后来很快就销声匿迹;68年后的1957年,它又重出江湖,而且势必所向披靡,因为除了70岁以上的老者,无人对它有抵抗力!
希尔曼判定,正在香港流行的流感病毒(被正式命名为亚洲流感)将会传遍全球。他进而预测亚洲流感将在当年9月的第一周,新学年开学之际,登陆美国。事实上,随后的研究表明,希尔曼在读到《纽约时报》的那条消息时,亚洲流感已经开始向外蔓延。4月底传到了台湾。5月初传到马来西亚和菲律宾。到了5月底,病毒已经传到印度、越南和日本。所到之处,造成的死亡人数不断增加,尤其是儿童。
为了遏止亚洲流感的势头,需要在病毒到达之前尽可能给广大的人群接种流感疫苗。希尔曼将他分离得到的病毒交给美国生产流感疫苗的六家公司,敦促它们以前所未有的速度,在四个月内大量生产疫苗。他甚至不忘记告诉那些疫苗厂家,要提醒各自的鸡蛋供应商保留足够的公鸡,才能提供充足的受精鸡蛋来生产疫苗病毒。这是因为希尔曼出生在蒙大拿州一个贫穷的农家,儿时的经验使他知道,养鸡户通常在蛋鸡繁育季节过后就把大部分配种公鸡都处理掉。当年6月,第一批亚洲流感疫苗出厂,并于7月开始接种。截至晚秋,总共有4000万剂流感疫苗投放市场。
不出希尔曼所料,1957年9月,亚洲流感通过返港的美国军舰在东西海岸同时登陆美国,进而扩散到全美。此后的几个月里,一共有2000万美国人罹患亚洲流感,造成7万人死亡。全球范围内,死亡的总数是400万。有人估计,如果没有疫苗,美国当年的流感死亡人数可能高达100万。希尔曼因其优异的工作表现获得美军的杰出服务奖章。
1968香港流感及2009 H1N1流感——疫苗有效,但为时太晚
亚洲流感爆发11年后的1968年,一株新出现的流感病毒又一次从香港开始,传遍世界,被称为香港流感,所造成的全球死亡人数估计为100 万至400万。这株病毒的传染性特别强,传播十分迅速,7月13日在香港被发现,7月底就扩散到越南和新加坡,9月份到达印度、菲律宾、澳大利亚、欧洲,同时通过越南战争的参战美军带回美国本土。此时希尔曼已离开WRAIR,在美国药业巨头默克(Merck)公司执掌其病毒及细胞生物学研究部门。希尔曼收到香港流感病毒样品后,迅速将它投入疫苗生产。在四个月内默克公司生产出了超过900万剂疫苗。可是此时香港流感在许多国家的流行高峰期已过,疫苗并没有充分发挥作用 [10]。
1968年香港流感之后的40年间,除了每年的季节性流感之外,未再发生过全球性的流感大爆发,直到2009年。这年3月,墨西哥中部一个乡村小镇出现流感病例,随即迅速向外扩散。墨西哥政府采取了关闭学校、取消群体活动等一系列公共卫生措施,试图阻止疫情蔓延,但收效不大。仅仅一个月,疫情就蔓延到邻近墨西哥的美国西南部。4月底,从南加州、德州以及墨西哥的病人身上分离得到了同一株新型流感病毒,研究之后发现这株新病毒起源于猪,因此一度被称为猪流感病毒,后来正式命名为A(H1N1)pdm2009。由于新病毒扩散的势头凶猛,4月26日,WHO有史以来第一次宣布,这是一项“国际关注的公共卫生突发事件”,敦促各国政府严密监控疫情发展。到了6月11日,鉴于全球急剧增加的病例数,WHO宣布流感大爆发已经发生。
2009年的流感大爆发有一个特点:通常年份季节性流感危害的对象除了幼儿之外,主要是老年人,而这场大爆发期间被感染的对象以及死者的年龄大多在60岁以下。尽管各国政府及公共卫生部门迅速作出反应,利用分离得到的A(H1N1)pdm2009病毒生产疫苗,新疫苗的开发周期、生产能力以及产品的分发派送环节却成为普遍预防接种的瓶颈。2009年,全世界每年流感疫苗的产能不到9亿剂,而当年的全球人口数是69亿。此外,这株猪流感病毒在鸡胚中的复制效率不高,致使疫苗病毒的产率很低,更加限制了疫苗的供应。以加拿大为例,新型流感病毒的流行始于夏季,至9月底达到高峰。此时才开始有疫苗可供民众接种,但数量严重不足。直到一个月以后,疫苗才得到充分供应,但流感疫情已开始消退,每日新增病例数不及高峰时的十分之一 [11]。
作为发达国家的加拿大,尚且遇到疫苗供应严重滞后于疫情发展的问题,广大发展中国家的情况更是可想而知。A(H1N1)pdm2009病毒从2009年春季开始爆发流行,11月在全球达到高峰,传遍五大洲两百多个国家和地区,直到次年5月以后逐渐消失。据估计全球人口的11%至21%遭到感染。所幸这株病毒的毒性较弱,多数病例症状轻微,甚至没有症状,病死率远低于通常年份的季节性流感。直接与间接的致死人数估计在15万到58万之间,大部分发生在公共卫生基础薄弱的非洲和东南亚国家 [12]。
从2010年秋季开始,A(H1N1)pdm2009成为每年季节性流行的流感病毒之一,直到今天。
2009年的这场流感大爆发再一次表明,尽管21世纪的医学科技和全球公共卫生体系与1918年的水平不可同日而语,面对突发的公共卫生紧急状况,仍然可能措手不及。尤其是现有流感疫苗的开发和生产模式,从分离鉴定出流行的病毒株到生产足够的疫苗供大规模接种之用,耗时太长,不足以及时应对一场突如其来的流感大爆发。现有流感疫苗的改进是当务之急。一条可能的途径,就是摒弃已经延用了七十几年的以鸡胚培养病毒,再加工成灭活疫苗的传统工艺,采取全新的疫苗策略,例如DNA或者mRNA核酸疫苗,来大幅度地缩短从确定疫苗病毒株到生产出疫苗的时间间隔。然而这条途径即使实现,如果我们还是只能跟随着流感病毒突变的进程,亦步亦趋地被动应对,年复一年,显然还是很不理想。有没有更好的策略?
流感病毒不论如何突变,万变不离其宗,仍然是流感病毒。换言之,所有的流感病毒都有某些共同结构是决定其关键功能的基础,不能轻易发生突变。现有研究成果已经表明,流感病毒感染后,有可能诱发针对这些共同结构的保护性免疫反应。能不能设计出一种疫苗,可以特别高效地诱发这样的保护性免疫反应?这就是所谓的"普适流感疫苗",或许只需接种一次或少数几次,就能激发对所有流感病毒变异株的免疫力。2018年,美国NIH在病毒传染病专家福奇博士(Anthony Fauci)的主持下,制定了研发普适流感疫苗的战略规划 [13]。希望研究人员梦想成真,普适流感疫苗早日问世!
1976猪流感事件——应对及时,或反应过度?
20世纪的三次流感大爆发,特别是1918年的西班牙大流感,给后来美国政府的公共卫生政策留下了影响。最突出的例子是1976年美国的猪流感事件。当年1月,新泽西州狄克斯堡的一处新兵训练营里,陆续有一些士兵得了流感。2月初的一天,有个十九岁的新兵向长官报告他身体疲倦不适。尽管如此,他还是参加了当天夜里的五英里急行军训练,随即体力不支,倒地而死,从发病到死亡还不到24小时。2月3日,州政府卫生局测试了从这些患病士兵采集的临床样本,发现多数病人感染的是当时正在流行的季节性流感病毒,但是从其中两例, 包括那名死亡的新兵,得到的是一种未知的流感病毒。2月10日,这个病毒样本被送到联邦政府疾病防控中心(CDC)作进一步分析,得到的结果令人震惊:它类似一种感染猪的流感病毒(猪流感因此得名)!
1976年的病毒学界一般认为,1918年的西班牙流感病毒最早起源于猪(虽然今天我们已经知道并非如此)。而新兵营爆发的流感,年轻力壮的青年猝死于发病第一天,猪流感病毒,这一切都使人不寒而栗地联想到1918年。对于西班牙流感大爆发之初政府反应迟缓处置不当所造成的惨痛后果,人们记忆犹新,这一次绝不能重蹈覆辙了!
CDC总监森瑟博士(David Sencer)立即在2月14日召开紧急会议,部署了对狄克斯堡及附近地区流感疫情的严密监控,以及对流感患者的流行病学调查。调查发现,患病的新兵并没有接触猪只的历史。当地社区内流行的都是已知的季节性流感病毒,然而新兵营里有两百多人虽然没有流感症状,血液里却已经带有能识别这种新病毒的抗体,表明新病毒已经在兵营内的人群中传播。而兵营之外,五十岁以下的居民中无人带有这样的抗体。不过奇怪的是,在那两个最早的猪流感病例之后,兵营内外再无同样的病例发生。
3月10日,CDC 再次召集各方开会。与会人员一致确认一种新的流感病毒已经出现,而且具备人际传播能力。由于人群中的绝大多数没有相关的抗体,对这种病毒没有免疫力,新病毒有可能造成流感大爆发。但是关于怎样应对这场可能的流感大爆发,会上却出现严重的分歧。与会人员的观点可大体归纳为以下三类:
其一,在两个猪流感的原始病例之后,一个多月再无其它病例出现,表明大爆发的风险已经降低,既然如此,何不按兵不动, 任其自生自灭;
其二,应当着手制造,采购及储存足够的疫苗,但暂缓开始接种,而是严密监控疫情,一旦发现猪流感爆发,立即启动接种;
其三, 新病毒即使暂时销声匿迹,也可能卷土重来。鉴于人群对猪流感病毒普遍缺乏抵抗力,等到疫情爆发才开始接种疫苗可能为时已晚,难以控制。为了防患于未然,应当尽快启动大规模的全民疫苗接种计划,理由是 “政府可以承受不必要的公共卫生开支负担,但不能承受流感大爆发造成的不必要的死亡和疾病之重。”[14]
森瑟博士是力主方案三的代表。
3月24日,时任美国总统福特亲自召集有关政府部门负责人及流感专家开会,默克公司的希尔曼也在与会者之列。福特总统拍板决定,由联邦政府拨款供猪流感疫苗项目上马之用。CDC将猪流感病毒交给纽约西奈山医学院的病毒学家,以最快的速度制成疫苗病毒株,默克公司立即将其投入生产,并计划到1977年1月共生产5000万剂。国会迅速通过“全民猪流感免疫计划”的立法。福特总统亲自在新闻发布会上宣布,要“为全体美国人民,不分男女老幼,一律接种猪流感疫苗。”全国媒体随之发动了宣传攻势,警告民众猪流感大爆发已迫在眉睫。各界社会名流纷纷出镜,敦促民众接种疫苗。 福特总统及家人带头接种疫苗的影像也反复在媒体出现。短短十周之内,就有4500万美国人接种了猪流感疫苗,占当时全美人口的四分之一,成为美国有史以来规模最大的一次公共卫生运动。
美国的猪流感疫苗接种正在如火如荼地进行,大洋彼岸日内瓦的WHO却是冷眼旁观,密切关注着全球猪流感疫情的发展。结果发现,不论在美国或者其它国家,直到1976年秋冬的流感季结束,可怕的猪流感大爆发并没有发生。这固然令人松了一口气,但是人们却开始怀疑,以如此高昂的代价应对一场不确定的危机,是否得不偿失?立即实行全民免疫计划的决定,是否做得过于仓促?如果当初暂不接种疫苗,而是密切监控疫情,是否更为明智?
在反对全民免疫计划的人士看来,大规模接种疫苗的恶果,除了劳民伤财之外,更糟糕的是在接种疫苗的4500万人中,发生了大约450例格林-巴利综合症。这是一种影响神经系统的自身免疫疾病,严重时可造成死亡(今天的流感疫苗接种指南中规定,有格林-巴利综合症病史者慎用流感疫苗,就是这个原因)。虽然发病率仅有十万分之一,严密的统计分析表明,这些病例确实与接种猪流感疫苗有关。
此时的美国朝野,一片质疑的声浪。 《纽约时报》以“一败涂地的猪流感免疫计划”为题发表社论,抨击全民免疫计划是主管公共卫生的官僚部门为了自身利益,玩弄政治权术的产物。森瑟博士被迫引咎辞职。福特总统在当年的大选中竞选连任失败, 有论者认为这与猪流感不无关系。
除了影响个人的政治生涯外,猪流感事件加深了美国民众对政府公共卫生政策的不信任以及对疫苗的疑虑,这一负面影响更为长久深远。
不过多年以后,森瑟博士撰文回顾1976年猪流感事件的前因后果时,坚持认为在当时的情况下,立即实施全民免疫计划是唯一正确的选择:“当生命受到威胁时,反应过度胜于反应不足。由于流感爆发的不可预见性,负责任的公共卫生领导人必须为了公众利益而勇于承担风险。”[14] 森瑟博士也检讨了从猪流感事件中应当吸取的教训,就是事关如此重大的公共卫生决策,应该多由权威的专业人士,而不是总统或其他行政官员,出面与民众沟通,讲清楚哪些决定是基于已经确立的科学知识,哪些是根据推测的结果,每个决定的风险何在,以尽量取得民众的支持;如此或可避免造成全民免疫计划是出于某人政治需求的误解。
1976年的猪流感事件,成了流感病毒和人类开的一个玩笑。这场疫苗风波已成历史。历史不是科学实验,不可能在严格控制的条件下重演。所以关于这场风波的争论,究竟谁是谁非,可能永远不会有答案。然而有一点公认无疑的,就是人类对流感病毒的了解实在太少了。尤其是1918年的西班牙流感病毒,究竟是怎样起源的?为什么造成的疾病如此凶险?它与后来几次流感大爆发的病毒,以及每年的季节性流感病毒有怎样的关系?怎样才能更有效地防范及应对未来可能的流感大爆发?直到近30年来,由于分子生物学和生物信息学的飞速发展,解决这些问题的曙光才开始呈现。
【华夏文摘】笑松:流感大爆发的百年回顾(三)
自从1918年的西班牙大流感之后,20世纪内又发生过两次流感病毒的全球大爆发。〔详见:笑松:流感大爆发的百年回顾(二)〕西班牙流感病毒是怎样起源的?为什么造成的疾病如此凶险?它与后来的流感大爆发,以及每年的季节性流感有怎样的关系?怎样才能更有效地防范及应对未来可能的流感大爆发?要回答这些问题,离不开直接对病毒进行研究。可是限于20世纪初的科技水平,尤其是在根本不知道流感病毒存在的情况下,不可能留下从现场采集后,以适当方法保存至今的西班牙流感病毒标本。对这种病毒的性状,长期以来只能通过流感幸存者当年被感染后体内产生的特异性抗体,来间接进行研究,犹如隔靴搔痒,盲人摸象。直到近30年来,由于分子生物学和生物信息学的飞速发展,解决这些问题的曙光才开始呈现。
西班牙流感病毒大揭秘
美国阿拉斯加州的西沃德半岛上有个叫泰勒的爱斯基摩小村庄,虽然远在冰天雪地的北极地带, 1918年也未能幸免西班牙大流感的蹂躏。历史文献记载,短短五天之内,这里的80个村民中就有72人被流感夺去性命。死者被集体埋葬于永久冻土层中的一处墓葬,地面上的标记只有两座十字架,在北极荒原的凛冽寒风中孤独地矗立了33年。
到了1950年代初,美国爱荷华大学有个研究生赫尔汀(Johan Hultin),他的研究方向是传染病的病原体,正想为自己的博士学位论文找一个课题。一天他听来访的一位病毒学家谈到1918年西班牙大流感留下的种种谜团,以及解决这些疑问的一条可能的途径:找到被封存在永久冻土层中的1918年流感死者的尸体,从中设法分离出流感病毒来进行研究。赫尔汀对这个想法极为着迷,跃跃欲试。经过一番研究后,他将目标锁定在阿拉斯加的泰勒,后来改名为布雷維的那个小村庄。
1951年,25岁的赫尔汀来到布雷維,征得村庄长老的同意后,开始发掘墓穴。这一过程并不容易。赫尔汀和他的几个同伴只有燃起篝火,先把冻土融化,才能向下挖掘。两天之后他挖到了第一具遗体,一个身穿蓝裙的小女孩,头发上还系着红丝带。接着又找到其它四具,从这些遗体分别采集了肺部组织标本,用干冰保存好。赫尔汀知道这样做有释放致命病毒的风险,因此尽其所能采取了防护措施。
将墓穴复原后,赫尔汀带着标本回到爱荷华,开始工作。他将肺部组织磨碎后注射到鸡胚,或者接种到不同的实验动物,希望能看到病毒生长。可是不论他如何努力,还是一无所获。很显然,即使那些肺部标本中真有病毒,也已经失去感染能力。赫尔汀的博士论文无疾而终,他也对研究生涯失去了信心,于是从研究生院退学,转而进了医学院。毕业后他来到加州,成为旧金山湾区的一名病理科医生,事业有成,直到退休。除此之外,赫尔汀还是一名汽车安全专家,业余建筑师,高山滑雪健将,一生过得多姿多彩。随着岁月流逝,当年探索西班牙流感病毒的失败经历,成为他记忆中一个越来越遥远的梦。
时间又过了40年,来到1990年代。美国军队病理学研究所保存着一批西班牙流感病患死亡后,经尸体解剖采集的肺部组织标本。这些病人都死于1918年秋季的第二波烈性流感。研究所的病毒学家陶本伯格(Jeffery Taubenberger)及其团队发现了这批标本。根据病历档案判断,这些病人多数死于流感之后的继发性细菌感染造成的肺炎,而已知在这个阶段,病人体内流感病毒的承载量已经大为减少。将这些细菌性肺炎病例排除后,还剩下13例死于发病后一周之内,直接死亡原因是流感病毒感染造成的肺部炎症、积水和出血,这些都是西班牙流感的病理学特征。
这些解剖标本经过甲醛固定,不可能含有任何活病毒。但是研究人员借助高灵敏度的核酸扩增技术,从一名21岁的死亡军人(1号病例)的肺部标本中,得到了流感病毒RNA的九个小片段。这些片段的基因序列表明,这个病毒不同于任何已知的流感病毒。西班牙流感的元凶终于在肆虐全球的70年后现身了!由于这名军人在1918年病逝于南卡罗来纳州,陶本伯格按照流感病毒命名的惯例,将这株病毒命名为甲型流感/南卡/1/18(H1N1)[Influenza A/South Carolina/1/18 (H1N1)]。
1997年3月,陶本伯格团队的发现在《科学》发表,论文标题为“1918年 ‘西班牙’流感病毒的初步遗传分析“ [15]。毫无疑问,仅靠这几个RNA片段,远不足以看清病毒的全貌。事实上陶本伯格根据这些有限的信息做出的一些猜测,后来被证明并不准确。但此时他手头的实验材料都已用完,怎样才能将工作再向前推进一步?就在这时,一封来信带来了意外的惊喜和希望。
早已退休的赫尔汀医生看到了陶本伯格的那篇论文,46年前的梦想电光石火般复活了。他立即给陶本伯格去信,自告奋勇要重返布雷維,再次寻找冻存的西班牙流感死者的肺部标本,供陶本伯格使用。他还表示此行的费用完全自理,如果一无所获,这事就算从未发生过。在得到陶本伯格的首肯之后,仅仅过了一周,赫尔汀就出发了。行囊中有一把园艺剪刀,是他太太在后院修剪树枝用的,赫尔汀未经许可就将它带走,打算用它来剪断尸体的肋骨,取得肺部组织。
1997年8月,72岁的赫尔汀再次来到布雷維。他又一次征得了村民委员会的同意,雇了几个村民帮他重新发掘那处墓葬。在冻土层中挖到两米深处时,发现了一具肥胖的女尸,肺部组织在脂肪的保护下保存得相当完整。赫尔汀给她起了个名字“露西”。此后,又陆续发现了三具遗体。赫尔汀分别取得肺部标本,浸泡在可以杀死病毒,但保全RNA的溶液中。
踏上归途之前,赫尔汀还做了一件事。他发现墓穴上的那两座十字架已经消失,于是他借用当地学校的木工房,连夜制作了两座,竖立在原处,作为对当年流感死难者的纪念。
回家之后,赫尔汀将肺部标本一分为三,通过三家不同的快递公司分别寄给陶本伯格,以防万一丢失。三套样品同时到达。十天之后,赫尔汀接到电话告知,从露西的标本中分离到了流感病毒RNA。赫尔汀的布雷維之行终于大功告成。
依靠露西的标本,以及美军病理研究所保存的1号病例和后来发现的2号病例肺部标本,到了2005年,陶本伯格团队终于拼接成功完整的西班牙流感病毒基因组 [16],前后历时共十年。赫尔汀成为陶本伯格团队关于西班牙流感病毒的两篇论文的共同作者,圆了他半个世纪前的梦 [17]。
流感病毒颗粒的表面由两种蛋白质分子构成:血凝素(HA)和唾液酸苷酶(NA)。这两种蛋白质在病毒感染宿主细胞的过程中起重要作用。感染人类的流感病毒可分为甲(A)型和 乙(B )型。其中甲型流感病毒已知的HA有18种(H1—H18),NA有11种(N1—N11),通过二者的组合形成许多不同亚型的病毒。每一种亚型又可以通过基因突变以及不同病毒株之间的基因重组,产生各种变异病毒。百年来四次大爆发的流感病毒都属于甲型,其亚型分别是H1N1(1918及2009年),H2N2(1957年)和H3N2(1968年)。
除了感染人类,流感病毒还能感染多种鸟类以及哺乳动物,特别是猪。不同亚型的病毒对不同物种的感染能力,引起的疾病严重程度,以及传播的效率各不相同。而猪既能被人流感病毒感染,又能被一些禽流感病毒感染。如果两种流感病毒感染了同一只猪,同时在猪体内的细胞中复制,就可能发生两种病毒的基因重组,产生新的杂种病毒。因此猪往往成为孵育流感病毒新变种的温床,以及流感病毒跨越物种传播的桥梁。
西班牙流感病毒基因序列的破解,为了解它的起源以及一百年来流感病毒的进化,提供了极为丰富的信息。携带各种生物遗传信息的核酸分子都是由A、T、G、C这四种碱基按一定比例组成的。已经知道禽流感病毒核酸分子的G、C碱基含量高于通常的人流感病毒。西班牙流感病毒核酸的G、C碱基含量更接近禽流感病毒而不是人流感病毒,这表明西班牙流感病毒很可能是起源于一种禽流感病毒,在1918年从禽类直接传播到人类,或者先以某种动物作为中间宿主,再感染人类。
通过比较西班牙流感病毒与不同时期流行的人类及动物流感病毒的基因序列,研究人员得以疏理出这些病毒相互之间的亲缘关系和演化的脉络。西班牙流感病毒有可能是在1918年的大爆发期间从人传播到猪,此后作为猪的流感病毒繁衍进化至今,其间通过突变以及与其它流感病毒的基因重组,造成了自1918年以来曾经在人类中流行过的大多数甲型流感病毒,包括历次流感大爆发的病毒。因此西班牙流感病毒可以被视为随后几次大爆发的流感病毒的老祖宗 [18]。
流感病毒感染宿主的第一个步骤,是通过HA分子结合到呼吸道细胞表面的受体。HA同时也是能防止流感病毒感染的保护性抗体所作用的主要靶点。1957、1968、2009年这三次流感大爆发的病毒中,唯有起源于猪的A(H1N1)pdm2009病毒的HA基因与西班牙流感病毒十分相似。这就解释了为什么在2009年的H1N1流感大爆发中,老年人的发病率和死亡率低于中青年:带有与西班牙流感病毒类似的HA的甲型流感病毒已经多年未在人类中流行,因此2009年的中青年普遍缺乏对它的免疫力。而60岁以上的老人早年有机会接触1918年之后不久曾经流传过、与西班牙流感病毒有较近亲缘关系的流感病毒,体内还留存一些能识别西班牙流感病毒HA分子的抗体,以及产生这些抗体的免疫记忆细胞。这些抗体也能识别A(H1N1)pdm2009病毒的HA分子,从而保护了这些老人免遭A(H1N1)pdm2009病毒感染。
在通常年份的季节性流感中,老年人总是作为需要加强保护的高风险对象,优先得到疫苗;而在2009年的流感大爆发早期疫苗供不应求时,由于及时确定了致病病毒的基因序列以及新病毒与西班牙流感病毒的关系,为合理分配有限的疫苗,优先接种真正的高风险年龄段提供了科学依据。1918年西班牙流感病毒基因序列的破解,为应对90年后的另一场流感大爆发做出了贡献。
研究西班牙流感病毒的基因序列,最重要的意义在于为防范未来的流感大爆发做准备。百年来流感病毒的演化历史告诉我们,造成大爆发的新型流感病毒可能有两个来源,一是自然界里从未感染过人类的野生禽流感病毒,穿越物种屏障感染人类;二是已经流行于人类和其它哺乳动物(例如猪)的病毒通过基因重组,获得新的基因片段,使其抗原性质发生重大变化,改头换面之后的新病毒得以躲过人群中已经普遍存在的流感病毒抗体,造成大规模的流行。认识到这些可能性,有助于增强对流感疫情的预测和有针对性的监控,以及新病毒一旦出现之后的有效应对措施。
然而有一些重要问题,单靠研究病毒的基因序列还无法解答:是什么因素,或者病毒的哪一个基因,使得西班牙流感病毒的毒性和传染性如此之强?病毒的这些性质只有在感染宿主以及复制扩增的过程中,通过与宿主细胞一系列复杂的相互作用,才能表现出来。
与狼共舞——重建西班牙流感病毒
1993年的好来坞经典大片《侏罗纪公园》里,科学家从一亿五千万年前吸吮过恐龙血液,随即被树脂包埋,后来转化成琥珀保存至今的蚊子胃里,分离得到恐龙的DNA,并且利用这些恐龙基因重新繁育出耀武扬威的活恐龙来。即使到了27年后的今天,这样的情节也还只能在科幻电影中出现。可是对于流感病毒这样简单的生命结构,一旦掌握了它的基因组的全部信息,21世纪初的病毒学家就有可能利用分子生物学手段重建出活病毒,对其性状进行观察。这也就是所谓的“反向遗传学”研究。
可是这一研究课题从立项之初就引起了争议。反对者认为这项研究将在实验室中复活一个曾经造成全球瘟疫、但早已灭绝的烈性病原体,这无异于一场与狼共舞的危险游戏,万一发生操作失误或者实验室泄漏的意外事故,将造成怎样的危害?万一复活的病毒被居心邪恶的恐怖分子获得,作为生物武器使用,后果更是不堪设想!支持者则坚信这一研究将为维护公众健康、防范流感大爆发提供重要的科学信息,而且今天的人群所接触过的流感病毒或多或少带有西班牙流感病毒的血统,由此可能已经获得一些1918年的人群所不具备的免疫力,因此西班牙流感病毒在今天未必还能像百年前那样所向披靡,造成同样的灾难。
一片争议声中,美国国家卫生研究院(NIH)组建了国家生物安全科学顾问委员会(NSABB),由一批微生物学、传染病、公共卫生、国家安全、生物安全、司法、出版等领域的专家组成,任务是针对那些具有正当合理的科学目的,但其结果如遭滥用,可能危及公众健康和国家安全的生物学研究项目(称为“双重用途项目”),提供指导意见。经过各方面专家的论证,重建西班牙流感病毒的研究被认定对社会的贡献超越其潜在风险。这一工作终于在严密的安全措施下开始进行。
西班牙流感病毒(以及其它甲型流感病毒)的RNA基因组是由八段单链RNA构成的,每个RNA分子分别带有一个或者两个病毒蛋白质基因。研究人员利用基因工程的方法,在实验室培养的细胞中制造出西班牙流感病毒的各种蛋白质成分,让它们和病毒的八个RNA片段自行装配成完整的有感染活性的病毒颗粒,再感染其它细胞,让新病毒扩增。
这一系列实验的最后一步——装配及扩增活病毒,是最关键、最危险的一步,由美国疾病防控中心(CDC)的病毒专家坦佩博士(Terrence Tumpey)负责进行。为了尽量减少研究人员遭意外感染的风险,只有他一人可以进入安全等级为增强版P3的实验室中的实验区域,接触有关的材料,进行实验。在此期间他必须预防性地服用抗流感病毒药物,而且事先签署知情同意书,万一他不幸被感染,将受到最严格的隔离。
2005年7月里的几周,坦佩每天在所有同事都下班离开后,才进入实验室,独自一人开始工作。同事们焦急地等待着他的消息。终于有一天,他们收到坦佩发出的电子邮件,内容只有一句话:“一个人的一小步,全人类的一大步。”这是1969年首位登月的太空人阿姆斯特朗在踏上月球时留下的名言。1918年的西班牙流感病毒复活了 [19]。
为了了解西班牙流感病毒的高毒性是由它的哪些基因决定,研究人员除了重建完全由西班牙流感病毒基因组成的病毒之外,还用西班牙流感病毒的不同基因代替低毒性的季节性流感病毒的对应基因,构建成一批所谓的“嵌合病毒”,即杂种病毒。用这些病毒分别感染小鼠、雪貂、猕猴等实验动物后,证明了西班牙流感病毒的几个不同蛋白质与其毒性有关。以小鼠为例,通常的季节性流感病毒不能感染小鼠,但带有西班牙流感病毒的HA基因和RNA聚合酶基因的嵌合病毒则可以在小鼠的肺部复制,造成炎症;而重建的西班牙流感病毒对小鼠的感染能力比嵌合病毒更强100倍,引起的肺炎症状更严重,显微镜下的肺部病理变化,与1918年西班牙流感死者的肺部标本相似 [20]。
虽然重建的西班牙流感病毒对人类的毒性不可能通过人体实验证实,一系列动物实验的结果清楚地表明,这个起源于鸟类的病毒对人类的毒性不是仅由单个基因决定,而是它的多个基因产物共同作用的结果。这也就提示我们,未来对人类危害最大、最致命的流感病毒,很可能又是某种禽流感病毒。虽然这样的流感大爆发自1918年以后未再发生过,自然界已经多次就此对我们发出警告,高致病性禽流感病毒像一柄达摩克利斯之剑,已经高悬在人类的头顶。
【华夏文摘】笑松:流感大爆发的百年回顾(四 )
研究人员借助最新的分子生物学手段,重建复活了已经灭绝的西班牙流感病毒。〔详见:笑松:流感大爆发的百年回顾(三)〕虽然重建的西班牙流感病毒对人类的毒性不可能通过人体实验证实,一系列动物实验的结果清楚地表明,这个起源于鸟类的病毒对人类的毒性不是仅由单个基因决定,而是它的多个基因产物共同作用的结果。这也就提示我们,未来对人类危害最大、最致命的流感病毒,很可能又是某种禽流感病毒。
H5N1禽流感病毒——“获得功能”与“失去功能”实验
流感病毒在自然界最主要的栖身处是野生水禽。这些鸟类所带的禽流感病毒很容易传染家禽。在现代养鸡场的高密度饲养条件下,随着病毒的快速传播复制,很容易发生变异,一旦出现高致病性的病毒变种,就能迅速导致家禽的大批死亡,造成严重的经济损失。
虽然禽流感病毒通常不感染人类,但也有例外。
1997年,一种高致病性甲型禽流感病毒H5N1在香港的养鸡场爆发流行,在此期间发现了禽流感病毒感染人类的病例:一共有 18个香港居民被H5N1病毒感染致病,其中6人死亡。为了控制疫情,香港养鸡场一共扑杀了120万只禽类。此后亚洲、非洲、大洋洲和欧洲的数十个国家先后发生过H5N1病毒感染人类的散发性病例,历年累计病例数超过700。通常年份季节性流感的病死率约为0.1%, 1918年的西班牙大流感的病死率约为2.5%,而H5N1禽流感病毒感染人类后的死亡比例却高达60%!
传染病流行的规模和造成的危害程度取决于两个因素,即病原体的致病性(毒性)和传染性。起源于禽类的H1N1西班牙流感病毒在人类中既有高致病性,又有能够持续人传人的强传染性。H5N1禽流感病毒感染禽类,在体内复制扩增后,从病禽的排泄物中大量排出。被H5N1病毒感染的人类病例都有过接触活禽或者到过活禽市场的历史,提示这些病人都是通过直接接触活禽排出的病毒感染的。所幸还没有发现过H5N1病毒从人到人传染的病例,说明天然存在的H5N1病毒还缺乏人际传播的能力。这或许是迄今为止阻碍禽流感病毒在人类中广泛流行的唯一屏障。
人无远虑,必有近忧。为了防范禽流感病毒突破物种屏障、在人群中大规模爆发的潜在风险,首先需要评估这道保护人类的天然防线究竟有多牢靠。
流感病毒从人到人的传播途径,最主要的是通过病人呼吸道喷出的飞沫和气溶胶。这种经由空气传播的能力可以用雪貂来研究。雪貂是研究人类流感病毒最常用的动物模型,原因是这种小型哺乳动物对流感病毒的易感性,感染后的症状和病理变化,尤其是病毒在不同个体之间的传播方式,都和人类相似。将两只雪貂分别关在一个铁丝笼内,两笼靠近并列放置,使两只雪貂不能直接接触,但气息相通。把待测的流感病毒接种到一只雪貂的鼻腔中使之发病,然后观察另一只雪貂是否会被发病雪貂隔空传染,如此即可判断病毒通过空气传播的能力。H1N1人流感病毒,包括季节性流感病毒和重建的西班牙流感病毒,都可以隔空传染雪貂;而H5N1禽流感病毒可以通过鼻腔直接接种感染雪貂,却不能通过空气传播进一步扩散到其它雪貂,正如禽流感病毒不能在人际传播一样。
流感病毒的细胞受体是唾液酸,一种单糖的衍生物。细胞表面的细胞膜上分布着许多糖蛋白,即带有一条链状多糖的蛋白质分子。如果某个细胞膜糖蛋白的糖链末端是一个唾液酸,这个细胞就能成为流感病毒感染的对象。感染的第一步是由病毒颗粒表面突起的HA分子抓住唾液酸,使病毒贴近细胞。唾液酸连接到糖链上的方式有两种,分别称为α-2,3连接和α-2,6连接。以这两种方式连接的唾液酸分子,形状略有不同。而不同流感病毒的HA分子形状也不完全一样。禽流感病毒,例如H5N1,其H5 HA分子的形状与α-2,3唾液酸匹配得好些,因此能把这个受体分子抓得紧些;而哺乳动物的流感病毒,例如感染人类的H1N1病毒,其H1 HA分子形状和α-2,6唾液酸匹配得好些,因此也就更容易抓住这种受体分子。
两种唾液酸受体在不同动物中的分布情况不一样。α-2,3唾液酸普遍存在于鸟类消化道的上皮细胞,所以H5N1禽流感病毒能感染鸟类的消化道并在其中复制扩增,通过粪便排出。人类和雪貂等哺乳动物的呼吸道中两种唾液酸受体都存在,但分布不均匀,上呼吸道,包括鼻咽部、气管、支气管等处主要是α-2,6唾液酸,而α-2,3唾液酸主要分布于下呼吸道,即肺部深处。这也就在一定程度上解释了何以只有偏好α-2,6唾液酸受体的H1N1病毒,能通过飞沫传播进入呼吸道,在人群中爆发流行,而偏好α-2,3唾液酸受体的H5N1禽流感病毒只有通过直接接触,大量进入人体,才有机会到达肺部深处,引起感染,造成重症肺炎。
2007年,坦佩博士利用重建的西班牙流感病毒进行实验,发现了一个重要结果:西班牙流感病毒能通过飞沫在雪貂间传播;但如果在其HA基因上引入两处突变,改变HA蛋白质分子上的两个氨基酸,突变后的HA蛋白质就从偏好α-2,6唾液酸受体转变成偏好α-2,3唾液酸受体,而带有这个突变的病毒则失去了通过飞沫传播感染雪貂的能力,但是依然能够经由鼻腔直接接种感染雪貂,造成死亡 [21]。
研究病毒的某种性状或者功能是否由一个特定的蛋白质决定,常用的方法是以人工改变这个蛋白质分子上的几个氨基酸,然后观察病毒是否因此失去、或者获得相关的功能。由于生物学实验固有的复杂性,病毒学家往往更青睐“获得功能”的实验,因为这样的实验结果受混杂因素干扰的机会较小,较易做出唯一的解释。
虽然坦佩与他的同事所做的仅是一个"失去功能"的实验,他们的结果清楚地表明,HA基因上区区两处突变,就将一个可以通过空气传播感染雪貂的烈性流感病毒,变成不能隔空传播,但依然能致死雪貂,类似H5N1禽流感的病毒。
如果把这一实验结果反转过来解读,不难做出如下推测:1918年,某种禽流感病毒的HA基因发生突变,病毒因此获得通过空气传播感染人类的能力,在人类中大爆发流行,这就是西班牙流感病毒的起源。
姑且不论关于百年前的西班牙流感病毒起源的这一推测正确与否,重要的是这样的事件在今天是否有可能发生?意识到这个问题的严重性,世界各国的流感病毒专家们纷纷开始进行研究。走在前列的是美国威斯康星大学的河冈义裕(Yoshihiro Kawaoka)和荷兰伊拉穆斯医学中心的福希尔(Ron Fouchier)。他们二人采取了不同的研究策略。
河冈用的是H5N1禽流感和H1N1人流感的嵌合病毒。他的团队首先在禽流感病毒的H5 HA基因上随机地制造出一系列的突变,然后用这些突变的H5 HA基因片段代替H1N1人流感病毒的H1 HA基因片段,制造出一个禽/人流感嵌合病毒的混合群体,其中不同的病毒颗粒带有不同的H5 HA突变基因。
天然禽流感病毒的H5 HA分子偏好α-2,3唾液酸,而不是α-2,6唾液酸。河冈团队造出一种只表达α-2,6唾液酸受体的细胞,与上述禽/人流感嵌合病毒的群体混合,从中“钓出”那些改变了受体偏好,能抓住α-2,6唾液酸的突变嵌合病毒,然后用雪貂试验这些突变嵌合病毒的致病能力和传播能力。带有天然H5 HA基因的禽/人嵌合病毒和天然H5N1禽流感病毒一样,可以通过鼻腔接种感染雪貂致病,但不能通过空气传播。河冈团队发现了一个能隔空传播感染雪貂致病的突变嵌合病毒,其突变H5 HA分子与天然H5 HA分子比较,只有四个氨基酸的不同。
这一结果是否表明,自然界里的H5N1禽流感病毒只要在HA基因上发生很少的几处点突变,就能获得在雪貂(可能也就是人类)中通过飞沫传播的能力?河冈团队没有证明这一点,因为他们的实验用的是自然界里并不存在的禽/人嵌合病毒。
与河冈几乎同时,福希尔直接从H5N1禽流感病毒下手进行研究。他的团队首先以基因工程的方法,在H5N1病毒的HA基因中引入两处突变,RNA聚合酶基因中引入一处突变。根据已知的数据,这几个突变可能有助于病毒感染哺乳动物的细胞。所得到的突变病毒可以经由鼻腔接种感染雪貂,但还是不能通过空气传播。
下一步,福希尔团队从一只被感染发病的雪貂鼻腔中取得病毒样品,接种到下一只雪貂鼻腔中。经过十次这样的连续接种传代后,终于分离得到了一批具有隔空传播能力的病毒株。分析了这些病毒株的核酸序列后,发现它们与天然H5N1禽流感病毒比较,至少发生了九个突变,其中有五个是所有突变病毒株共有的,包括三个人工引入的起始突变和两个在传代过程中增加的额外突变。不仅如此,福希尔团队得到的H5 HA基因上的突变位置与河冈团队得到的四个突变十分相近。
殊途同归,河冈与福希尔在实验室中得到的结果都强烈地提示,只需要在天然H5N1病毒基因组中引入少数几个突变,就可以使禽流感病毒获得在雪貂之间隔空传播的能力。
最后一个问题就是,这样的突变事件在自然界发生的机会有多大?
河冈和福希尔与英国剑桥大学的数学家史密斯(Derek Smith)合作,将他们各自的突变H5 HA基因与数据库中已有的、从禽类直接分离得到的各种H5N1病毒株比较,发现有些天然存在的H5N1变异病毒的HA基因只需再发生三处,甚至两处点突变,就与他们人工制造的突变病毒完全相同了。他们进而构建了一个数学模型,用以模拟天然H5N1病毒感染哺乳动物后发生突变的速率,得到的结论是H5N1病毒在细胞中复制扩增后,的确有可能增加三个突变,使病毒能通过飞沫或气溶胶传播 [22]。
换句话说,如果雪貂实验的结果可以外推到人类,那就表明,自然界里已经存在一些H5N1禽流感病毒的变异株,只需再加两个特定的点突变,就有可能变成既有高致病性,又具备从人到人的强传染性的新型病毒!河冈和福希尔对此深信不疑。
H5N1论文风波
2011年8月,河冈和福希尔将他们各自的论文分别投到《自然》和《科学》。紧接着, 福希尔在一次专业会议上披露他的部分研究结果,引起了强烈的争议。争议的焦点在于,对高致病性禽流感病毒进行“获得功能”的改造,使之具备强传染性,是否妥当?这一消息被嗅觉灵敏的媒体抓到,立即大张旗鼓地报道,掀起了一股轩然大波:致死率超过50%的禽流感病毒已经令人谈虎色变,再加强它的传播能力,岂不是为虎添翼?
NIH规定,具有潜在的双重用途的研究结果,在正式发表前必须经过NSABB审核。河冈和福希尔的H5N1研究课题都是由NIH资助的。2011年12月,NSABB应NIH的要求对两篇文稿进行了审议。委员们认为,两项研究的成果的确有益于生物医学和公共卫生事业,例如可用于监控自然界的鸟类群体中出现的可能在人际传播的H5N1突变病毒,以及开发相关的治疗药物和疫苗;但另一方面,全文发表两篇论文的潜在风险超过了这些利益。主要的风险是居心不良的个人或组织可能利用这些研究结果,制造出能导致全球大流行的流感病毒,作为生物武器。尤其是福希尔团队的工作,由于所用的是天然高致病性禽流感病毒,风险更高。另一个顾虑是其它实验室在重复这些实验时,万一操作不慎造成突变病毒的意外泄漏。因此NSABB的专家们一致决定,两篇论文都必须经过删改,隐去关键的技术细节后,才能发表。所删除的技术细节只能提供给“负责任的研究人员和公共卫生官员”作为内部参考。
NSABB作出决定后,福希尔与河冈为了平息公众和政府部门的担忧,联络了世界各国从事H5N1病毒研究的专家共39人,于2012年1月在《科学》联名发表了一份声明 [23]。声明中指出,流感大爆发是公众健康面临的最大威胁之一,而充分准备应对流感大爆发的最大障碍,则是缺乏禽流感病毒在人类中的传播能力的有关数据。声明中同时强调,所有署名作者领导的实验室中, H5N1病毒在哺乳动物中的传播实验都是在政府的严密监管下,按照最严格的生物安全标准进行的,可以有效地防止病毒的泄漏。
声明的作者们提议召开一次国际会议,对这一研究项目及相关问题进行深入的讨论,以期达成共识。为了给有关的组织和人员充分的时间来准备会议,作者们将在自愿的基础上,将一切旨在增加高致病性H5N1禽流感病毒传播能力的实验暂停60天,已有的能在雪貂间传播的突变病毒以及嵌合病毒的实验也一律暂停。采用天然H5N1病毒的实验则不在暂停之列。
2012年2月, WHO出面组织了一次会议,邀请各国的禽流感病毒专家、《自然》和《科学》两刊的编辑、以及来自11个国家的公共卫生官员,对河冈和福希尔的论文进行讨论。风向终于变了。与会者认为,鉴于这项工作的科学价值及其对公众健康的意义,两篇论文都应该完整地发表;删节论文及限制发表不仅客观上难以实施,而且违背科学研究的公开性质和自由探索精神。
河冈和福希尔将他们的论文修改后重新提交NSABB审查。NSABB于3月底再次开会研究后,认定修改后论文的详细程度已经不足以供恐怖分子依样画葫芦,造出生物武器,因此可以全文发表了。还有一个重要原因是福希尔的论文中增加了新的实验结果,表明他的突变病毒虽然得到了隔空传播的能力,但毒性减弱了,被感染的雪貂无一死亡。NIH采纳了NSABB的建议,批准了两篇论文的发表。河冈的论文首先于2012年5月在《自然》刊出 [24]。福希尔的论文则又延迟了一个多月,直到6月底才在美国的《科学》发表 [25],原因是他的论文必须先得到荷兰政府颁发的出口许可证,才能投递到国外期刊,否则论文作者可能被判处监禁6年。
两篇论文虽然发表了,争议并没有结束。尤其是福希尔的论文,NSABB的18名委员中还是有六人反对全文发表。会后有人写信给NSABB的上级主管部门,指责NSABB的两天会议期间没有充分听取反对派人士的意见。支持派人士认为河冈和福希尔的工作有益于防控禽流感在人类大爆发,主要的根据是,实验室里发现的H5 HA基因突变可用于监控自然界里可能造成人类大爆发的变异禽流感病毒;反对派对此也有针锋相对的观点:天然存在的H5 HA基因可以通过无数不同的突变方式来改换对唾液酸受体的偏好,对此根本无从监控,因此二人的工作完全没有必要进行!
这场关于H5N1研究论文发表的风波之后,NIH进一步加强管控具有潜在双重用途的生物医学研究项目,尤其是涉及“获得功能”实验的课题,对这些项目的获益和风险的评估,实施过程中的生物安全措施,以及研究结果的分享和发表,都做出了一系列更为严格细致的规定。
H7N7及H7N9禽流感——警钟再鸣
继H5N1禽流感之后,2003年春天,欧洲的荷兰、比利时和德国的禽类养殖场爆发了H7N7禽流感,并且发现感染人类的病例,共有82人遭到感染,其中一人死亡。为了控制疫情,近3000万只禽类被扑杀,经济损失惨重。
到了2013年,在中国的上海和安徽又发现了另一种亚型的高致病性禽流感病毒H7N9。从2013年3月开始的4年间,多个省份陆续发生了五波H7N9感染人类的事件,而且有愈演愈烈之势。仅2017年初的第五波爆发中就有766人遭到感染,使累计病例数增加一倍,达到1567例,大大超过了历年被H5N1病毒感染的人数,总的病死率为39%。与H5N1一样,大部分病人都有直接接触禽类或家禽市场的历史。但令人担忧的是,有个别病例无法完全排除有限人传人的可能。除此之外,从家禽体内分离得到的有些H7N9病毒株对禽类的致病性不强,禽类感染后的症状轻微,这更增加了监控病毒在禽类中流行情况的难度。
为了防控高致病性禽流感病毒的流行,自2017年9月开始,中国在养鸡场实行了疫苗接种计划,采用的是针对H5N1和H7N9两种病毒的禽用H5/H7双价疫苗。接种取得了良好的效果:养殖鸡群中分离得到H7N9病毒的样品数量降低了93.3%。更重要的是,从2017年10月到2018年2月,总共只发生了三例H7N9病毒感染人类,此后再无新病例出现,表明H7N9禽流感病毒已经得到控制 [26]。
可是H7N9禽流感仅仅平息了一年, 2019年3月底,内蒙古自治区阿拉善旗又发现一个H7N9病毒感染人类的病例,患者不治身亡。在患者住家附近200米内有两处家禽屠宰场,研究人员从其中一处采集的样品中分离得到了H7N9病毒,与感染患者的病毒相同。经过对病毒基因组的分析,发现这株新病毒与以往流行的高致病性H7N9病毒有明显不同,新病毒的HA基因上已经发生了几处突变,使得原来的疫苗失去了保护效果。新疫苗的研制和应用迫在眉睫 [27]。
道高一尺,魔高一丈
人类和自然界中的流感病毒,以及其它潜在新发病原体的抗争,势必继续下去。在未来的角逐中,人类能够占得先机吗?
英文中的pandemic(疾病大流行)一词,起源于两个希腊文词根: pan-(全体)和demos (人民)。每一次流感或者其它传染病的大爆发,都可能影响全人类的命运,不分国界种族,贵贱贫富;应对这样的灾难,世界各国唯有同舟共济,通力合作,才有可能化险为夷。
病毒学界早已形成共识并且一再发出警告,流感病毒的下一次全球大爆发只是时间早晚的问题 [28]。世界各国的医疗救护体系,公共卫生体系,医药工业体系,乃至整个国民经济体系,是否有充足的准备和完善的应对措施?当今社会的每一分子,从政府高官到平头百姓,是否都有直面最坏情况的心理准备?为了防止,或者至少是尽量推迟类似1918年西班牙大流感那样的瘟疫再一次发生,有哪些事情我们应该从现在就开始做起?
百年来历次流感大爆发的历史,为防范及应对下一场流感大爆发,以及任何一种大规模流行性传染病,提供了充分的正面经验和反面教训。每一场令人类付出沉重代价的瘟疫之后,如不认真反思,吸取前车之鉴,做到亡羊补牢,惨痛的历史就必然重演,再次坐实黑格尔绝望的断言“世人从未以史为鉴”。谓予不信,2020年席卷全球的新型冠状病毒疾病COVID-19就是明证。
(全文完)
主要参考资料
- CDC. Pandemic Influenza. https://www.cdc.gov/flu/pandemic-resources/basics/past-pandemics.html.
- Barry JM. The great influenza: the epic story of the deadliest plaque in history. New York: Penguin Books, 2018.
其它参考文献
[1] Hatchett RJ et al. Public health interventions and epidemic intensity during the 1918 influenza pandemic. Proc Natl Acad Sci U S A. 2007; 104: 7582-7.
[2] Bootsma MC & Ferguson NM. The effect of public health measures on the 1918 influenza pandemic in U.S. cities. Proc Natl Acad Sci U S A. 2007; 104: 7588-93.
[3] Lewis PA & Shope RE. Swine influenza: II. A Hemophilic bacillus from the respiratory tract of infected swine. J Exp Med. 1931; 54: 361-71.
[4] Shope RE. Swine influenza : III. Filtration experiments and etiology. J Exp Med. 1931; 54: 373-85.
[5] Smith W et al. A virus obtained from influenza patients. Lancet. 1933; 2: 66–68.
[6] Van Epps HL. Influenza: exposing the true killer. J Exp Med. 2006; 203:803.
[7] Li L et al. Influenza-associated excess respiratory mortality in China, 2010-15: a population-based study. Lancet Public Health. 2019; 4: e473-e481. doi: 10.1016/S2468-2667(19)30163-X.
[8] Huo X & Zhu FC. Influenza surveillance in China: a big jump, but further to go. Lancet Public Health. 2019; 4: e436-e437. doi:10.1016/S2468-2667(19)30158-6.
[9] Offit, PA. Vaccinated: One Man’s Quest to Defeat the World’s Deadliest Diseases. Smithsonian Books/Collins, New York, 2007.
[10] Encyclopaedia Britannica. https://www.britannica.com/event/Hong-Kong-flu-of-1968 .
[11] Broadbent AJ & Subbarao K. Influenza Virus Vaccines: Lessons from the 2009 H1N1 pandemic. Curr Opin Virol. 2011; 1: 254–62.
[12] CDC. 2012. First Global Estimates of 2009 H1N1 Pandemic Mortality Released by CDC-Led Collaboration. https://www.cdc.gov/flu/spotlights/pandemic-global-estimates.htm.
[13] Erbelding EJ et al. A Universal Influenza Vaccine: The Strategic Plan for the National Institute of Allergy and Infectious Diseases. J Infect Dis. 2018; 218: 347-54.
[14] Sencer DJ & Millar JD. Reflections on the 1976 Swine Flu Vaccination Program. Emerging Infectious Diseases. 2006; 12: 29 – 33.
[15] Taubenberger K et al. Initial Genetic Characterization of the 1998 “Spanish” Influenza Virus. Science. 1997; 275: 1793-6.
[16] Taubenberger JK et al. Discovery and characterization of the 1918 pandemic influenza virus in historical context. Antivir Ther. 2007; 12:581-91.
[17] Jordan D. The Deadliest Flu: The Complete Story of the Discovery and Reconstruction of the 1918 Pandemic Virus. https://www.cdc.gov/flu/pandemic-resources/reconstruction-1918-virus.html.
[18] Morens DM et al. The persistent legacy of the 1918 influenza virus. N Engl J Med. 2009; 361: 225-9.
[19] Tumpey TM et al. Characterization of the reconstructed 1918 Spanish influenza pandemic virus. Science. 2005; 310:77-80.
[20] Taubenberger JK et al. Reconstruction of the 1918 influenza virus: unexpected rewards from the past. mBio. 2012 Sep 11;3(5). pii: e00201-12. doi: 10.1128/mBio.00201-12.
[21] Tumpey TM, et al. A two-amino acid change in the hemagglutinin of the 1918 influenza virus abolishes transmission. Science. 2007; 315: 655-9.
[22] Russell CA et al. The potential for respiratory droplet-transmissible A/H5N1 influenza virus to evolve in a mammalian host. Science. 2012; 336: 1541-7.
[23] Fouchier RA et al. Pause on avian flu transmission research. Science. 2012; 335: 400-1.
[24] Imai M et al. Experimental adaptation of an influenza H5 HA confers respiratory droplet transmission to a reassortant H5 HA/H1N1 virus in ferrets. Nature. 2012; 486: 420-8.
[25] Herfst S et al. Airborne transmission of influenza A/H5N1 virus between ferrets. Science. 2012; 336: 1534-41.
[26] Zeng X, Tian G, Shi J, Deng G, Li C, Chen H. Vaccination of poultry successfully eliminated human infection with H7N9 virus in China. Sci China Life Sci. 2018; 61: 1465-73.
[27] Yu D et al. The re-emergence of highly pathogenic avian influenza H7N9 viruses in humans in mainland China, 2019. Euro Surveill. 2019; 24(21). doi: 10.2807/1560-7917.ES.2019.24.21.1900273.
[28] Morse SS. Pandemic influenza: studying the lessons of history. Proc Natl Acad Sci U S A. 2007; 104: 7313-4.
作者投稿
华夏文摘第一五四七期(cm1120d)
喜欢我的文章吗?
别忘了给点支持与赞赏,让我知道创作的路上有你陪伴。
发布评论…