
Just a random pufdeck
2019冠状病毒传播起源初探
版权归作者所有,任何形式转载请联系作者。
作者:Lawrence Lee(来自豆瓣)
来源:https://www.douban.com/note/750329932/
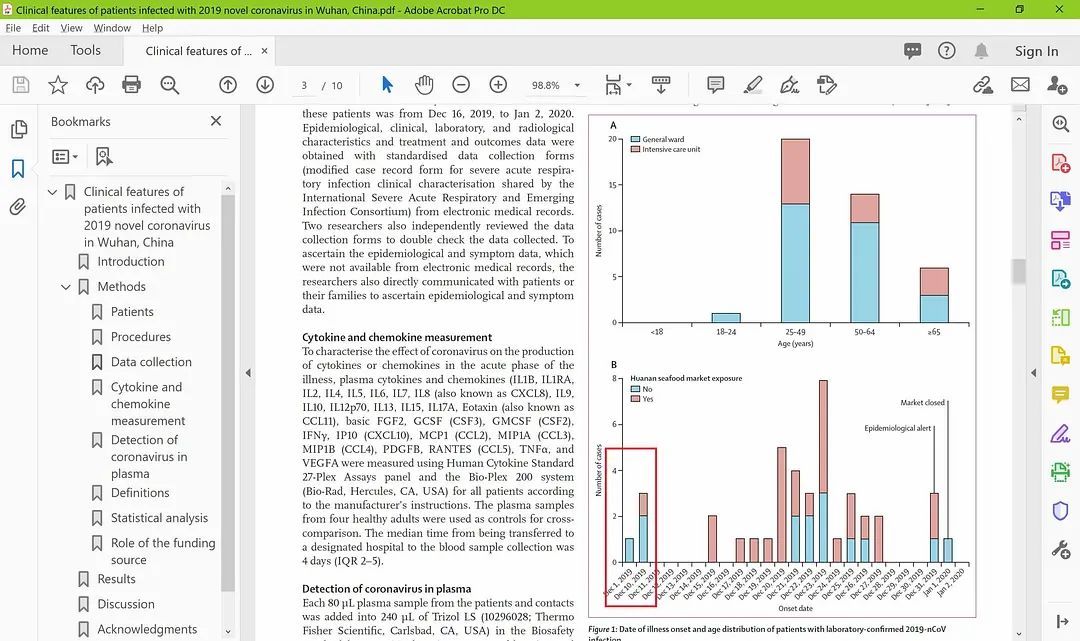
2020年1月24日,武汉金银滩医院统计了41位中重症患者的临床症状,并在医学期刊The Lancet(柳叶刀)上发表题为【Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China(受中国武汉2019新型冠状病毒感染的患者的临床特征)】的专文,分享了感染者临床症状的表现统计,但未透露关于第一例感染者的详细信息。一直以来,华南海鲜市场被广泛认为是传播的始发地,但查看这篇文章的图表一(Figure 1)不难发现,2019年12月1日出现的第一名感染者,并没有华南海鲜市场接触史。12月8日确证的三位感染者中的两位亦没有接触过华南海鲜市场。
而即使很多野生动物身上携带冠状病毒,这些冠状病毒是通过何种方式(如接触或摄入)进入人体,并因何种外部条件变异成可以感染人体的病毒,也一直未找到令人满意的解答。另外,如野生动物传播说成立,何以只有武汉人被感染呢?暂且不说中国其他省市也有喜欢吃野生动物的人,东南亚诸国皆不乏嗜食野味者,即使不像武汉这般大面积爆发,也应该是多地同时发现疫情。然而目前中国其他地域与其他国家的确诊患者,都是由武汉输入的感染者传染。这样不合逻辑的现象,只能用【武汉的野生动物比较特殊,最先感染人的方式也比较特殊,是其他地域无法复制的】这一说法来解释。那到底特殊在哪,第一例感染者又究竟是如何被感染的呢?
这次的冠状病毒被命名成新型冠状病毒,是因为是之前未发现过与之完全相同的正链单股RNA冠状病毒。南开大学生命科学院、医学院及东部战区总医院联合发布的一篇题为【武汉2019冠状病毒基因组的生物信息学分析】的论文中,通过对病毒基因组的分析,倾向于认为这一冠状病毒源自中华菊头蝠(Horseshoe bat),因beta冠状病毒存在大量的可变翻译而体现出与SARS冠状病毒的差异。中国疾病预防控制中心在分离毒株并经过生物体外培养后,也承认新型冠状病毒在基因序列上与蝙蝠携带的类SARS病毒变种有约86%的相似性。如果我们假设这次的新型冠状病毒就是从蝙蝠携带的类SARS病毒变种变异产生的,那它是如何获得对人类的可感染性呢?我们不妨从病毒的Envelope Protein(覆膜蛋白)入手。
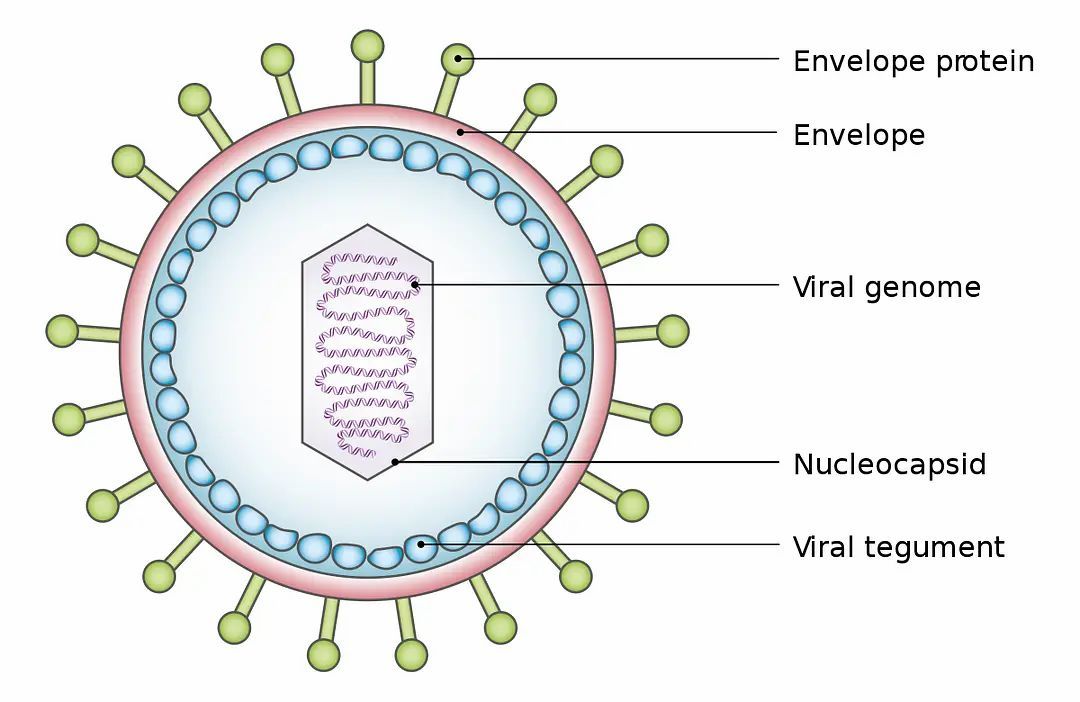
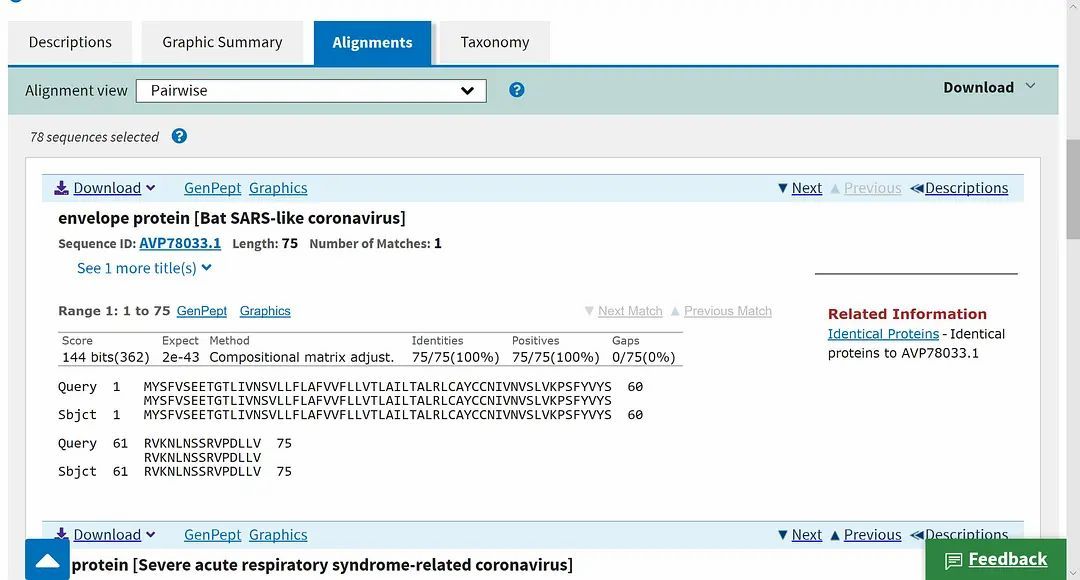
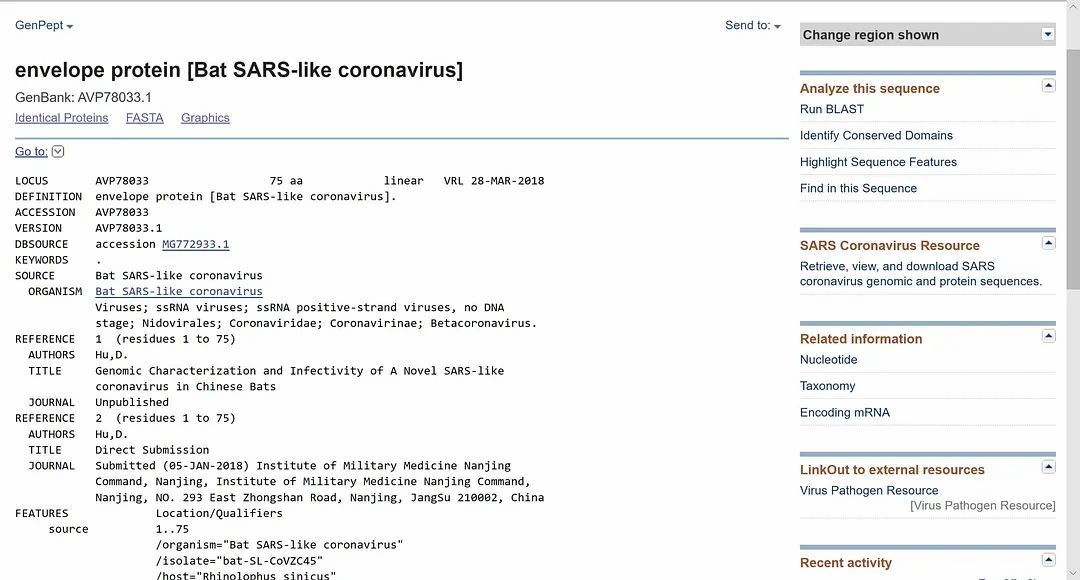
病毒的覆膜(viral envelope),覆盖在病毒的保护性蛋白质核衣壳(protective protein capsid)上,在病毒进入细胞后会与宿体的细胞膜相融合。不同的覆膜蛋白,对病毒进行基因传输(gene transfer)的效率有很显著的影响。比如HIV病毒的覆膜蛋白(如rgp160 和rgp120)因快速进行着进化与变异,极大地削弱了抗体(antibody)的有效性。在U.S. National Library of Medicine - National Center for Biotechnology Information(美国国家图书馆医学部--生物科技资讯中心)的基因资料库(GenBank)中,我们可以查询新型冠状病毒的详细序列(见下图),目前共收入不同采集时间与地域的24个样本。因测量与采集的方式不同,各样本的序列存在一些细微差异。
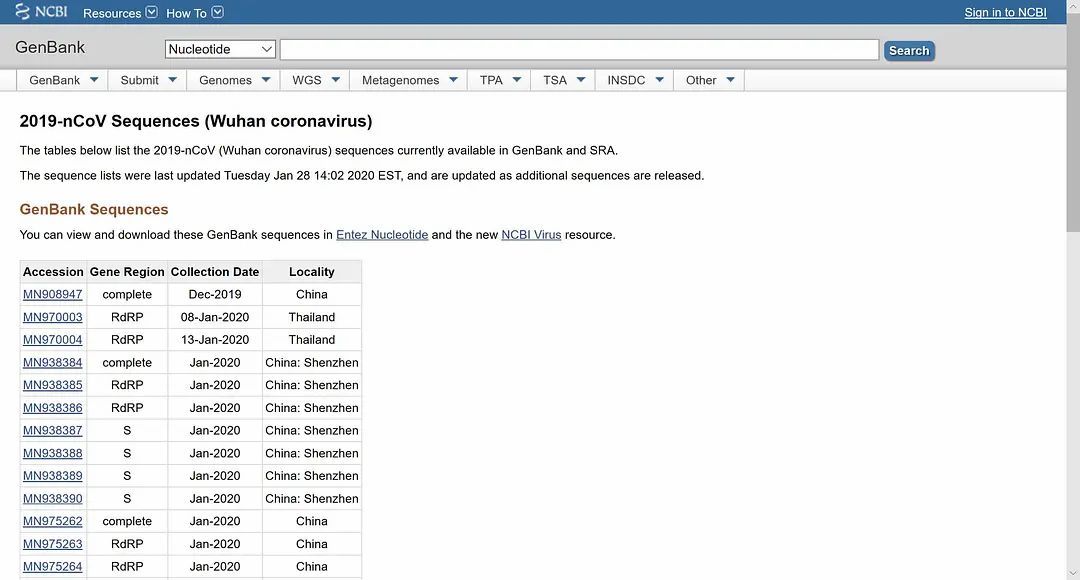
其中最新采集的几例,分别是1月22日、1月23日在美国加利福尼亚州采集的两例与1月22日在阿利桑那州采集的一例,因采集程序严谨,且检测出的覆膜蛋白序列完全相同,可作为我们的主要研究对象。将这个序列输入生物科技资讯中心的Basic Local Alignment Search Tool 搜索引擎,检索是否存在其他与之序列相似的病毒覆膜蛋白,结果令人惊异。根据比对,一种蝙蝠携带的类SARS病毒的覆膜蛋白与武汉发现的新型冠状病毒覆膜蛋白相似度竟达到100%(见下图)。

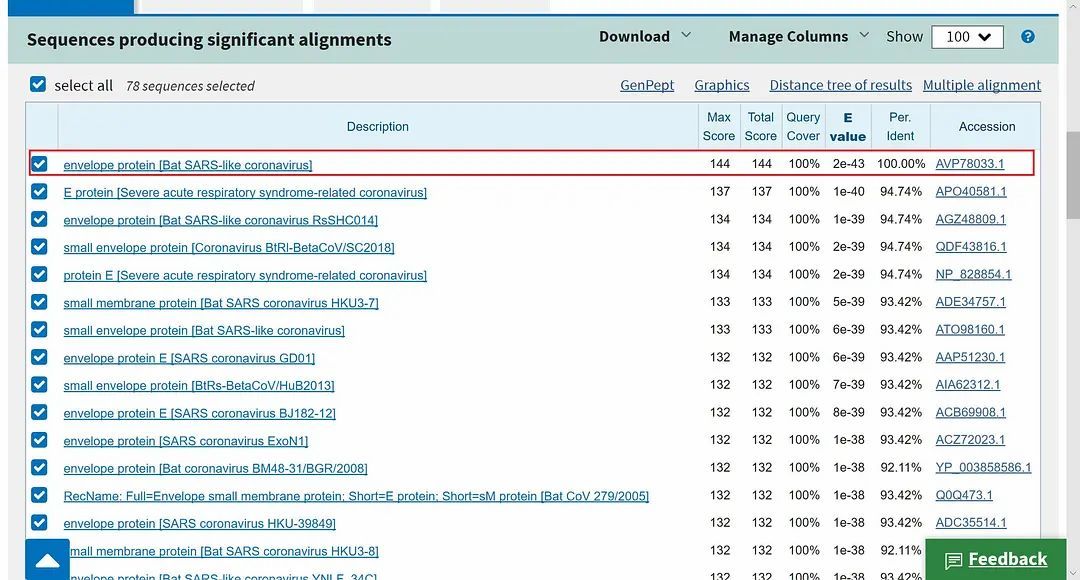
这种蝙蝠携带的类SARS病毒的基因信息,由南京军事医学研究院在2018年3月28日提交。而相关的论文,如【Genomic characterization and infectivity of a novel SARS-like coronavirus in Chinese bats(中国蝙蝠携带的新型类SARS冠状病毒的基因组表征与传染性)】发表于2018年9月12日,作者来自第三军医大学,浙江大学医学院与江苏省疾病预防控制中心,文章讨论了这种新型类SARS病毒跨物种传播的可能性。而观察与研究这种病毒的场所,是BSL-4 (P4) 级别的中国科学院武汉病毒研究所 。据中国官方期刊【Biosafety and Health (生物安全与健康)】的主编吴桂珍的介绍,【在2004年发生实验室SARS病毒泄露事件后,中国卫生部启动了保存SARS、其他冠状病毒和流行性强的流感病毒等高级别病原体实验室的建设】。建设成果即是中国科学院武汉病毒研究所。武汉病毒所配备了动物研究设备,且中国的动物研究法规相较西方宽松很多。美国生物安全咨询公司CHROME的创始人Tim Trevan就表示,要研究冠状病毒的治疗方法与疫苗,在人体测试前的最后一步是让动物感染。而美国新泽西州罗格斯大学分子生物学家Richard Ebright博士则表示,此类实验具有不可预测的危险性,【动物可能飞、跑、抓挠及咬人,它们携带的病毒散布在指甲与牙齿上】。
早在2007年,武汉病毒所(当时还并非P4等级)的【石正丽和崔杰课题组】便在中国各地采集了数千只马蹄蝠样本进行观测。武汉病毒所亦对蝙蝠的15种病毒株的基因组进行测序,发现它们包含了构成感染人类的病毒的所有基因片段。武汉病毒所在变为P4等级后并未放弃对蝙蝠研究的兴趣,以病毒所的名义发表过多篇论文,如2017年的【Novel bat adenoviruses with low G+C content shed new light on the evolution of adenoviruses(低G+C含量的新型蝙蝠腺病毒为腺病毒的进化提供的新启示)】,及2019年的【Rapid and Specific Detection of All Known Nipah virus Strains' Sequences With Reverse Transcription-Loop-Mediated Isothermal Amplification (通过逆转录环介导等温扩增法对所有已知尼帕病毒株序列做针对性的快速侦测)】。后一篇提到了武汉病毒所将泰国蝙蝠的RNAs与其他基因分离株合成,并将合成物插入pUC57载体。
谈回病毒覆膜蛋白,正常理解中,新型冠状病毒具有感染人体的特征,是因为某些外部条件触发了蝙蝠携带的类SARS病毒的自然突变。然而自然变异发生时,理论上病毒覆膜蛋白的序列不可能不发生任何改变。基于此,根据目前掌握的信息推断,并不能排除「新型冠状病毒是通过基因编辑蝙蝠携带的类SARS病毒而得到的产物」这一假设。
(下一篇将从检视相关部门调查感染源的方式,分析蝙蝠携带的类SARS病毒经过何种突变具有了对人的传染性,以及讨论武汉病毒所一位研究者及其团队从事的特定研究這三个角度,进一步探究2019年新型冠状病毒的传播起源)
2019冠状病毒传播起源初探(其二)
让我们继续谈2019冠状病毒的起源。在第一篇文章中(link:https://www.douban.com/doubanapp/dispatch?uri=/note/750329932/&dt_dapp=1),我简单讨论了事件的背景,提出了两个事实依据:1. 2019年的新型冠状病毒的覆膜蛋白(Envelope Protein)与南京军事医学研究院在2018年3月28日提交的蝙蝠携带的类SARS病毒的覆膜蛋白有100%的序列相同性。2. 中国科学院武汉病毒研究所一直在做与蝙蝠携带的类SARS病毒相关的研究,且P4级别的研究所的建立初衷是希望研究危险性高的病原体时,不再如2004年时一般发生SARS病毒泄露。
第二篇文章,我们要进一步分析新型冠状病毒的传播起源,先从讨论这种病毒为什么可以实现跨物种传播并感染人开始。冠状病毒想入侵人体,需要由病毒的纤突蛋白(Spike protein)与宿体细胞结合与膜融。而这次的新型冠状病毒的纤突蛋白,氨基酸序列与SARS接近,折叠构型也相类,很可能也是通过纤突蛋白裂解后与ACE2 (Angiotensin converting enzyme 2(血管紧张肽转换酶2))这一受体结合形成通路入侵人体,在构象改变后才能侵染细胞内的Cathepsin L(组织蛋白酶L)。当然,如果被入侵的受体的肺部上皮细胞能持续分泌 Elastase(胰肽酶-E),则新型冠状病毒可以在这种酶的作用下,通过与细胞质膜融合的方式快速进入宿体细胞。这或许也是新型冠状病毒传播效率高于SARS的原因(SARS病毒只有在侵染早期可以促进Elstase的产生)。我们用一个图片简单解释冠状病毒获得入侵人体所需的蛋白motif(模体结构):
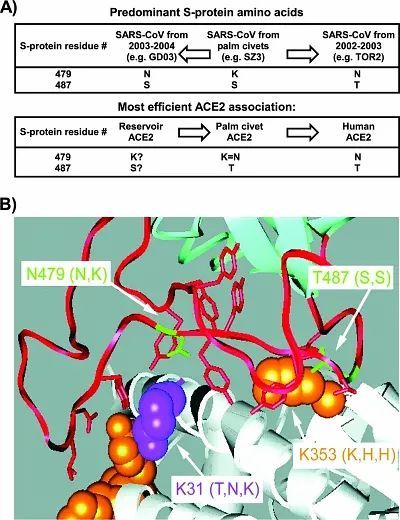
冠状病毒获得入侵人体所需的motif(模体结构)
N479与T487是最易被观察到的纤突蛋白的氨基酸残基分布位置,橙色部分是病毒入侵时氨基酸残基将ACE2转化成纤突蛋白受体,紫色部分则显示了赖氨酸31(lysine 31)防止ACE2与纤突蛋白结合的位置。蝙蝠本身携带的冠状病毒,并不具备令纤突蛋白与受体成功结合的motif,也就是现在新型冠状病毒蛋白的motif,是原蝙蝠携带的冠状病毒经过多次变异后再结合而成的(recombination with subsequent mutations)(Li, W., S. K. Wong, F. Li, J. H. Kuhn, I. C. Huang, H. Choe, and M. Farzan. 2006. Animal origins of the severe acute respiratory syndrome coronavirus: insight from ACE2-S-protein interactions. J. Virol. 804211-4219)。具体蝙蝠携带的类SARS是如何变异重组的呢?请参考我准备的下一张图:
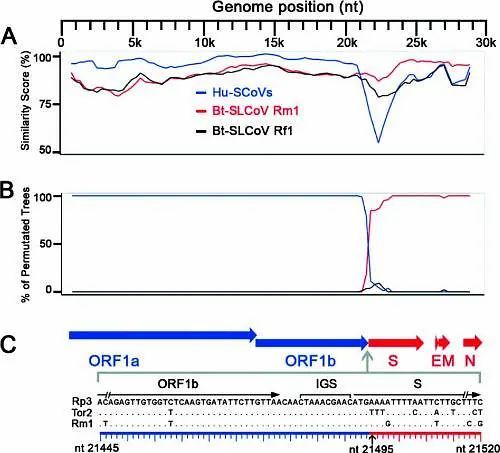
冠状病毒株的基因组重组断点,相似度图与重排分析
这张图是冠状病毒株的基因组。A是基因相似度图,B是分子重排分析。可以感染人类的毒株包括Tor2 (AY274119), GD01 (AY278489), ZJ01 (AY297028), SZ3 (AY304486), GZ0402 (AY613947), 以及PC4 (AY613950) 。C显示了重组前基因断点(breakpoint)的位置。大部分基因重整与重组会损害蛋白质结构或者原具有功效性的基因组排列(functional gene combinations),从而对病毒本身的存活产生非常不利的影响,因此跨种族的冠状病毒传播才变得困难。原生物体携带的病毒经过自然变异重组后纤突蛋白可以有效结合新生物体内的受体是概率非常小的情况,这也就是所谓的生物屏障。比如之前武汉病毒所就发现了蝙蝠携带的冠状病毒变异后可以感染猪的情况,将之命名为SADS-CoV(猪急性腹泻综合征冠状病毒),我们可以参考一篇研究团队发布的论文,叫做【Fatal Swine Acute Diarrhea Syndrome caused by an HKU2-related Coronavirus of Bat Origin (一种与HKU2相关的蝙蝠起源的冠状病毒引起的致命猪急性腹泻综合征)】,这种自然变异后的病毒的纤突蛋白就无法在人类体中找到有效受体,也因此无法感染人。需要注意的是,这篇文章的作者有武汉病毒研究所石正丽研究员,还有武汉病毒研究所周鹏研究员。石正丽研究员长期做蝙蝠研究,我在第一篇文章中已经提过了,本文最后还会重点谈谈周鹏研究员。
这次的新型冠状病毒,因纤突蛋白的特殊结构获得对人类的感染性。而现在我们面临的问题是,南京军事医学研究院在2018年3月28日提交的蝙蝠携带的类SARS病毒是如何在保证覆膜蛋白100%不发生任何变化的前提下,纤突蛋白发生如此有效、甚至可以说是有针对性的变异,而获得对人类的感染性呢?第一例感染者又是如何与蝙蝠接触被感染的呢?蝙蝠身上的病毒变异的条件是什么?是通过中间宿主吗?显然不可能,如此覆膜蛋白一定会发生改变。这次的新型冠状病毒的纤突蛋白与SARS的氨基酸序列并不完全相同,但折叠构型为何如此相似,几乎像是为了可以与ACE2结合而设计的。那可不可能是人为干预了原病毒基因的变异与重组呢?
我们再看一篇论文,2015年11月9日发表的【A SARS-like cluster of circulating bat coronaviruses shows potential for human emergence(类似于SARS的循环蝙蝠冠状病毒毒簇显示了人类感染出现的潜在可能)】,其中作者之一葛行义先生的工作单位也是武汉病毒所。这篇论文论证了冠状病毒跨种族传播的潜在风险,并为了实验需要用SARS-CoV reverse genetics system(SARS冠状病毒反向遗传体系),以蝙蝠携带的冠状病毒为基础来重组合成了一种嵌合病毒来针对性地感染老鼠。SARS冠状病毒反向遗传体系是先分别以两个痘苗病毒(vaccinia virus)为受体克隆SARS冠状病毒(vSARS-CoV-5prime以及vSARS-CoV-3prime),形成两个cDNAs后结合在一起,创建一个基因组长度的针对体外转录(in vitro transcription)的SARS-CoV cDNA模板。(详见Yount, B. et al. Reverse genetics with a full-length infectious cDNA of severe acute respiratory syndrome coronavirus. Proc. Natl. Acad. Sci. USA 100, 12995–13000 (2003) 。换言之,在实验室中通过蝙蝠携带的类SARS冠状病毒来制造可以高效感染人体的新型冠状病毒在现实可操作性上是完全存在的,而结合新型冠状病毒覆膜蛋白与纤突蛋白的特征,这种新型冠状病毒是蝙蝠携带的原病毒通过自然突变产生的可能性因实在太低,近乎是因未被明确证伪而仅存在理论上的可能。
我们再来看看有关部门调查感染源的方式。通过管轶教授的描述可知,华南海鲜市场并没有经过仔细的现场保护,事实上,事发后所有现场痕迹都被清理干净,以至于病毒源以无法通过收集现场样本推断。当然,参考我在第一篇文章中的讨论,华南海鲜市场几乎可以肯定并非第一现场,最先出现的感染者除了一例,皆没有华南海鲜市场接触史。这唯一的一例,按逻辑推理,也并非是在华南海鲜市场感染,而是在别处感染后,因去了华南海鲜市场,将携带的病毒传播给其他身处华南海鲜市场的人,以至于后来的几例患者都具有华南海鲜市场接触史,海鲜市场也因此被当作第一现场。除了清理现场,目前未见有关部门对感染源进行过针对性调查,第一例感染者的详细情况也从未对外界公布。从后续的宣传分析,甚至可以理解成有关部门刻意让公众认为海鲜市场就是第一现场。
最后我们讨论武汉病毒所的一位研究员及其团队从事的研究。这位研究员就是上文提到的周鹏。在武汉病毒所工作的周鹏被媒体(长江日报)形容成【全球蝙蝠免疫研究第一人】,2018年1月和病毒所的同事石正丽共同发表过一篇登在Cell Host & Microbe的论文【Dampened STING-Dependent Interferon Activation in Bats (蝙蝠弱化的STING依赖的干扰素激活反应)】,研究了蝙蝠在DNA损伤和DNA免疫通路中存在的与其他哺乳动物不同的特性。2019年11月18日,周鹏公开招募博士后协助研究蝙蝠携带类SARS冠状病毒但不发病的分子机制,似乎是这篇论文研究项目的延申。最早在2010年2月12日,周鹏写的论文【Immunogenicity of the spike glycoprotein of Bat SARS-like coronavirus(蝙蝠携带的类SARS冠状病毒的纤突糖蛋白的原免疫性)】,就是通过对病毒株的重组实验研究可能的冠状病毒抗体。无论是STING免疫途径的实验还是病毒株重组的实验,都存在使所研究的蝙蝠携带类SARS冠状病毒定向变异的可能。
招聘启事
希望这两篇文章,能为探究2019冠状病毒的起源创立一个基础,接下来的调查方向很明确,我们需要更多的信息,比如武汉病毒所样本管理的记录,周鹏去年10月到12月正在研究的项目的数据,第一位感染者的病毒采样及活动史等等,但在中国的环境下,取得这些信息的难度是有目共睹的。
喜欢我的文章吗?
别忘了给点支持与赞赏,让我知道创作的路上有你陪伴。
发布评论…